
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
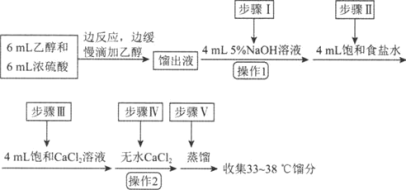
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是________________。
(4)仪器D中盛有冰水混合物,其作用为________________。
(5)操作1的名称为________,操作2的名称为________。
(6)若省略步骤Ⅱ会导致的后果是________。
【答案】分液漏斗 CH3CH2OSO2OH+CH3CH2OH![]() H2SO4+CH3CH2OCH2CH3 防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质 使乙醚冷凝为液体以便收集 分液 过滤 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀
H2SO4+CH3CH2OCH2CH3 防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质 使乙醚冷凝为液体以便收集 分液 过滤 用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀
【解析】
(1)仪器B为分液漏斗;
(2)已知总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,第一步反应为CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,第一步反应为CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,两式相减,可得第二步反应为CH3CH2OSO2OH+CH3CH2OH
CH3CH2OSO2OH+H2O,两式相减,可得第二步反应为CH3CH2OSO2OH+CH3CH2OH![]() H2SO4+CH3CH2OCH2CH3;
H2SO4+CH3CH2OCH2CH3;
(3)乙醇易挥发,为防止滴入的乙醇受热被蒸发,提高产物的产率,减少杂质,反应过程中,仪器B的末端应浸入反应液中;
(4)仪器D中盛有冰水混合物使乙醚冷凝为液体以便收集;
(5)通过操作1将溶液与乙醚分离,乙醚不溶于水,故为分液;操作2分离吸水后的氯化钙水合物固体与乙醚,故为过滤;
(6)若省略步骤Ⅱ,乙醚粗品混有少量步骤I的 NaOH ,用饱和氯化钙溶液洗涤乙醚粗品时,析出氢氧化钙沉淀。


科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
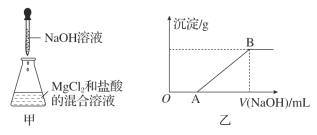
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有________ (填字母)。
a. 天平 b. 烧杯 c. 漏斗 d. 玻璃棒
(2)OA段反应的化学方程式为_____________________________________。
(3)AB段反应的化学方程式为________________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是______________________,反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)易与C发生化学反应的酸是________,反应的化学方程式是_______________ 。
(2)将C与纯碱混合,在高温熔融时发生化学反应也可生成D,同时还生成B的最高价氧化物E;将E与D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:____________________、__________________。
②要将纯碱在高温下熔化,下列坩埚中不可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ksp(NiS)≈1.0×10-21,Ksp(ZnS)≈1.0×10-25,pM=-lgc(M2+)。向20mL0.1mol·L-1NiCl2溶液中滴加0.1mol·L-1Na2S溶液,溶液中pM与Na2S溶液体积的关系如图所示,下列说法正确的是( )
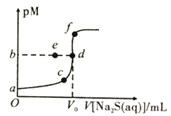
A.图像中,V0=40,b=10.5
B.若NiCl2(aq)变为0.2mol·L-1,则b点向a点迁移
C.若用同浓度ZnCl2溶液替代NiCl2溶液,则d点向f点迁移
D.Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
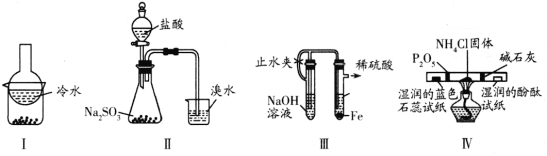
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学让生活更美好。他一直在践行,如消除饮用水中的有毒物质,保证人民的生活质量。
(1)饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,可以在过量NaOH溶液的条件下用铝粉将
的浓度,可以在过量NaOH溶液的条件下用铝粉将![]() 还原为N2,写出其其离子方程式为:______________________________________________。
还原为N2,写出其其离子方程式为:______________________________________________。
上述反应中,_________元素的化合价升高,则该元素的原子_______(填“得到”或“失去”)电子。当有1mol N2生成时,反应中转移电子的数目为____________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为__________________________________________________。(已知,氯气在石灰乳中发生歧化反应,其中一种产物是Ca(ClO)2)
(3)KA1(SO4)212H2O的俗名为_________,因其溶于水生成_____________(化学式)可以吸附杂质,从而达到净水作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取1 molA、B、C、D、E、F六种有机物,使它们充分燃烧,都生成44.8LCO2(标况),D和E是碳、氢、氧的化合物,两都互为同分异构体,E被氧化成A,A继续氧化成B,C和F都发生聚合反应,C和氯化氢加成生成F。试推断有机化合物A、B、C、D、E、F的结构简式。
A.___、B.____、C.___、D.___、E.___、F.___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com