
【题目】已知常温下,Ksp(NiS)≈1.0×10-21,Ksp(ZnS)≈1.0×10-25,pM=-lgc(M2+)。向20mL0.1mol·L-1NiCl2溶液中滴加0.1mol·L-1Na2S溶液,溶液中pM与Na2S溶液体积的关系如图所示,下列说法正确的是( )
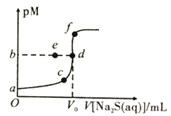
A.图像中,V0=40,b=10.5
B.若NiCl2(aq)变为0.2mol·L-1,则b点向a点迁移
C.若用同浓度ZnCl2溶液替代NiCl2溶液,则d点向f点迁移
D.Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+c(H2S)
【答案】C
【解析】
向20mL0.1mol·L-1NiCl2溶液中滴加0.1mol·L-1Na2S溶液,反应的方程式为:NiCl2+Na2S= NiS↓+2NaCl;pM=-lgc(M2+),则c(M2+)越大,pM越小,结合溶度积常数分析判断。
A.根据图像,V0点表示达到滴定终点,向20mL0.1mol·L-1NiCl2溶液中滴加0.1mol·L-1Na2S溶液,滴加20mL Na2S溶液时恰好完全反应,根据反应关系可知,V0=20mL,故A错误;
B.根据图像,V0点表示达到滴定终点,溶液中存在NiS的溶解平衡,温度不变,溶度积常数不变,c(M2+)不变,则pM=-lgc(M2+)不变,因此b点不移动,故B错误;
C.Ksp(NiS)≈1.0×10-21,Ksp(ZnS)≈1.0×10-25,ZnS溶解度更小,滴定终点时,c(Zn2+)小于c(Ni2+),则pZn2+=-lgc(Zn2+)>pNi2+,因此若用同浓度ZnCl2溶液替代NiCl2溶液,则d点向f点迁移,故C正确;
D.Na2S溶液中存在质子守恒,c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选C。


 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
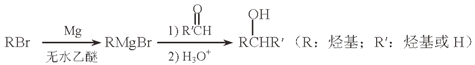
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:
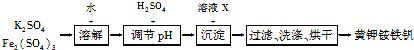
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g,则黄钾铵铁矾的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
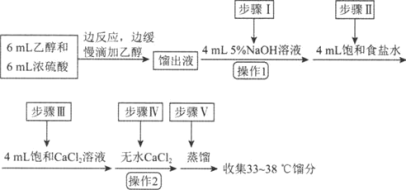
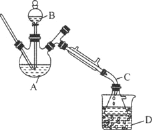
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是________________。
(4)仪器D中盛有冰水混合物,其作用为________________。
(5)操作1的名称为________,操作2的名称为________。
(6)若省略步骤Ⅱ会导致的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是有机合成中的重要试剂。某同学用如图装置,由NO与干燥纯净的Cl2反应制备NOCl。
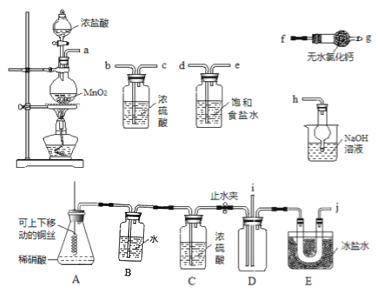
己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃②2NO+Cl2=2NOC1![]() 2NO2+Cl2=2NO2Cl
2NO2+Cl2=2NO2Cl
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为______。
(2)图中实验装置的连接顺序为:a→_______。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是______;装置中充满氯气后,下—步是制取NO,具体操作是______;E中冰盐水的温度可低至-22℃,其作用是______。
(4)该同学的实验设计可能的不足之处是______(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化亚铬是一种化学品,化学式Cr(OH),外观棕褐色沉淀。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬,二价铬再与氢氧化钠溶液作用即可制得氢氧化亚铬。实验装置如图所示。回答下列问题:
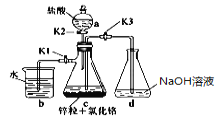
已知:(1)Cr(OH)的性质和Fe(OH)相似,制备的时候要严格隔绝氧气
(2)Cr3+ 绿色,Cr2+亮蓝色
(1)实验中所用蒸馏水需要逐气,原因是_______________________,所需方法是__________。
仪器a的名称是____________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。①c中溶液由绿色惭变为亮蓝色,该反应的离子方程式为:____________________。
②同时c中有气体产生,该气体是______________ ;其作用是____________。
(3)打开K3,关闭K1、K2。c中亮蓝色溶液流入d中,其原因是______________________;
(4)指出d装置可能存在的缺点_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. C6H14所有的同分异构体中主链为4个碳的只有2种
B. CH3CO18OCH2CH3在酸性条件下水解能得到CH3CH218OH
C. 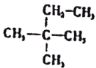 的名称是2-甲基-2-乙基丙烷
的名称是2-甲基-2-乙基丙烷
D. ![]() 与
与![]() 是同一种物质
是同一种物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com