
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是
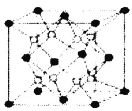
A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为共价键
C.晶格能:氧化镁>氧化钙
D.该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
【答案】B
【解析】
立方晶胞中:每个顶点的原子被8个晶胞共有,所以晶胞对顶点原子只占![]() 份额;每条棱的原子被4个晶胞共有,所以晶胞对顶点原子只占
份额;每条棱的原子被4个晶胞共有,所以晶胞对顶点原子只占![]() 份额;每个面上的原子被2个晶胞共有,所以晶胞对顶点原子只占
份额;每个面上的原子被2个晶胞共有,所以晶胞对顶点原子只占![]() 份额;内部原子不与其他晶胞分享,完全属于该晶胞;金属晶体是通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体;同主族元素的离子,离子半径越小,对应氧化物的的晶格能越大;
份额;内部原子不与其他晶胞分享,完全属于该晶胞;金属晶体是通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体;同主族元素的离子,离子半径越小,对应氧化物的的晶格能越大;
A、依据均摊规则,晶胞中含有的铁原子个数为8×![]() +6×
+6×![]() =4,含有8个镁原子,故化学式为Mg2Fe,故A正确
=4,含有8个镁原子,故化学式为Mg2Fe,故A正确
B、铁镁合金的晶体中存在的化学键类型为金属键,故B错误;
C、在元素周期表中,镁元素在钙元素的上一周期,故Mg2+半径比Ca2+半径小,氧化镁的晶格能大,故C正确;
D、一个晶胞中含有4个“Mg2Fe”,其质量为![]() ×104g/mol=
×104g/mol=![]() g,故D正确。
g,故D正确。
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
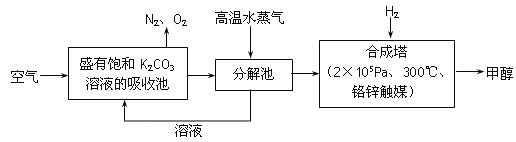
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是______________________________________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-=== CO2 + 6H+
则正极发生的反应是__________;放电时,H+移向电池的______(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
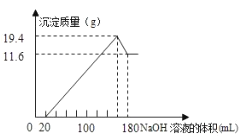
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、SO32-、SO42-
B.1.0mo1·L-1的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C.在![]() =l×l012的溶液:NH4+、Ca2+、Cl-、K+
=l×l012的溶液:NH4+、Ca2+、Cl-、K+
D.甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列化合物的电子式:
①CO2:_______________;②Na2O2:______________;③N2:________________;
(2)有下列物质:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气
回答下列问题:
①不存在化学键的是:______________________________________。
②只存在非极性键的是:_____________________________________。
③只存在离子键的是:_______________________________________。
④ 既存在离子键又存在极性键的是:___________________________。
⑤ 既存在离子键又存在非极性键的是:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能。下列说法中不正确的是
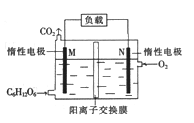
A. M极作负极,发生氧化反应
B. 电子流向:M→负载→N→电解质溶液→M
C. N极的电极反应:O2+4H++4e-=2H2O
D. 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末甲由FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中的若干种组成,取一定量的固体甲进行如下实验:
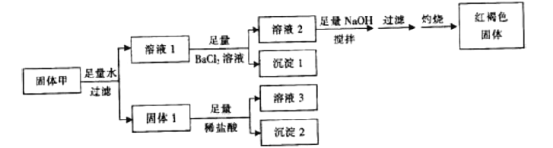
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g。下列说法正确的是( )
A. 溶液Ⅰ加入KSCN溶液呈红色
B. 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl
C. 固体Ⅰ与稀盐酸反应时还生成了标准状况下气体1.12L
D. 沉淀2不溶于任何酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统,放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
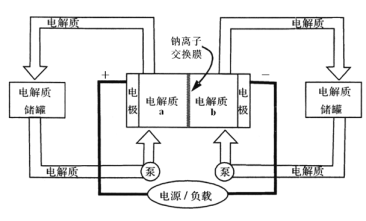
A. 放电时,负极反应为3NaBr-2e-=NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-=Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40gNa2S4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com