
【题目】(1)写出下列化合物的电子式:
①CO2:_______________;②Na2O2:______________;③N2:________________;
(2)有下列物质:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气
回答下列问题:
①不存在化学键的是:______________________________________。
②只存在非极性键的是:_____________________________________。
③只存在离子键的是:_______________________________________。
④ 既存在离子键又存在极性键的是:___________________________。
⑤ 既存在离子键又存在非极性键的是:___________________________。
【答案】![]()
![]()
![]() ⑥ ③ ④ ② ⑤
⑥ ③ ④ ② ⑤
【解析】
(1)①二氧化碳为共价化合物,分子中含有碳氧双键;
②过氧化钠是由钠离子和过氧根离子构成的离子化合物;
③氮气是双原子分子,分子中含有氮氮三键,氮原子最外层达到8电子稳定结构;
(2)①金属铜是金属单质,单质中存在金属键;
②NaOH是离子化合物,化合物中存在离子键和极性共价键;
③I2是非金属单质,单质中存在非极性共价键;
④MgCl2是离子化合物,化合物中存在离子键;
⑤Na2O2是离子化合物,化合物中存在离子键和非极性共价键;
⑥氩气为单原子分子,分子中不存在共价键。
(1)①二氧化碳为共价化合物,分子中含有碳氧双键,C、O原子最外层都达到最外层8个电子,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②过氧化钠是由钠离子和过氧根离子构成的离子化合物,两个氧原子通过共用1对电子结合,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
③氮气是双原子分子,分子中含有氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①不存在化学键的是单原子分子氩气,故答案为:⑥;
②只存在非极性键的是非金属单质I2,故答案为:③;
③只存在离子键的是离子化合物MgCl2,故答案为:④;
④ 既存在离子键又存在极性键的是离子化合物NaOH,故答案为:②;
⑤ 既存在离子键又存在非极性键的是离子化合物Na2O2,故答案为:⑤。


科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
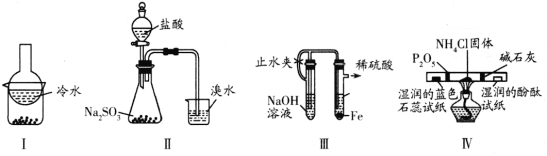
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过反应:3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
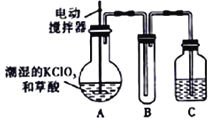
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_____。
(2)请分析装置图,进行补充和完善。A部分缺________装置,B部分还应补充_______装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离子方程式____。
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是__________、__________、__________(不考虑Cl2的挥发)。
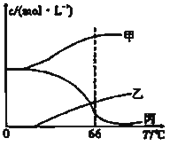
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取1 molA、B、C、D、E、F六种有机物,使它们充分燃烧,都生成44.8LCO2(标况),D和E是碳、氢、氧的化合物,两都互为同分异构体,E被氧化成A,A继续氧化成B,C和F都发生聚合反应,C和氯化氢加成生成F。试推断有机化合物A、B、C、D、E、F的结构简式。
A.___、B.____、C.___、D.___、E.___、F.___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是
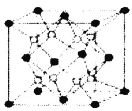
A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为共价键
C.晶格能:氧化镁>氧化钙
D.该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
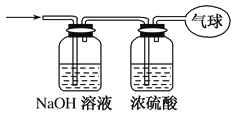
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组进行化学实验,按照图(左)连接好线路发现灯泡不亮,按照图(右)连接好线路发现灯泡亮。由此得出的结论正确的是( )
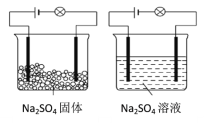
A.Na2SO4固体不导电,所以Na2SO4固体是非电解质
B.Na2SO4溶液能导电,所以Na2SO4溶液是电解质
C.Na2SO4在水溶液中电离方程式:Na2SO4=2Na++SO42-
D.Na2SO4溶液中,水电离出大量的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是

A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
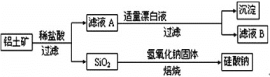
(1)在滤液A中加入漂白液,所得滤液B显酸性。
①滤液A中加入漂白液的目的是:________________________(用离子方程式表示)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)___________。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
发生反应的离子方程式为____________
(2)检验滤液B中是否还含有Fe2+的选择的试剂及现象为:_______________________________________
(3)若将铝土矿溶于足量的氢氧化钠溶液,则对应的离子方程式为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com