
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
【答案】5.4 C、E、F、G、H ① B、C、D
【解析】
(1)浓硫酸的物质的量浓度为![]() ,设所需浓硫酸的体积为V,则有
,设所需浓硫酸的体积为V,则有![]() ,
,
则![]() ,因此,本题正确答案是:5.4;
,因此,本题正确答案是:5.4;
(2)操作步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1-2cm时,改用胶头滴管滴加,所以需要的仪器为筒量、胶头滴管、烧杯、玻璃棒、100mL容量瓶,因此,本题正确答案是:CEFGH;
(3)①定容观察液面时俯视,溶液体积偏小,浓度偏大,故①正确;
②容量瓶使用时未干燥,无影响,浓度不变,故②错误;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,因为刻度线以上的滞留溶液会下来,溶液的体积偏大,浓度偏低,故③错误;
因此,本题正确答案是①;
(4)A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,所以A选项是正确的;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大,故B错误;
C、氢氧化钠易潮解,故应放到烧杯中称量,氢氧化钠在溶解过程中会放热,要等冷却至室温再转移进容量瓶,故C错误;
D、配制溶液时,要先稀释,冷却至室温以后,再转移至容量瓶,故D错误;
E、摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故E正确.
所以BCD选项是正确的.


科目:高中化学 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比可能为( )
A.13:8:29B.22:1:14C.29:8:13D.44:2:23
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 常温下2S2O(g)![]() 3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D. 氯水通入SO2后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行A(g)+2B(s)![]() 2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 容器内气体平均相对分子质量不变时达到化学平衡状态
C. 温度不变,增大B的投入量,正反应速率增大
D. 温度不变,压缩容器体积重新达到平衡后,A的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式___,如图的曲线中__(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
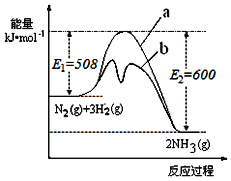
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1L的容器中加入1molN2、3molH2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=___。
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为___。
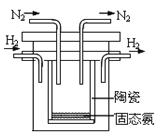
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
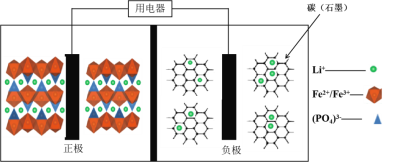
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )
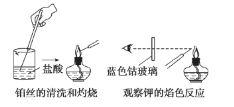
A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L氢气中含有2NA个中子
B. 0.1NA个氯化氢分子占有体积为2.24 L
C. 2克金属钙变成钙离子时失去的电子数为0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的c(H+)约为_________。
③与明矾净水原理相似,FeCl3净水的原理是:________________(用恰当文字回答)
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
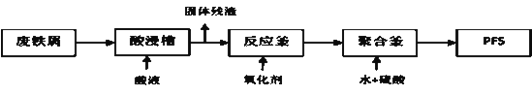
①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
③检验其中Fe2+是否完全被氧化,可选择__________(填标号)。
a.KMnO4溶液 b.Na2SO3溶液 c.KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com