
【题目】为了保护环境,充分利用资源,可将工业废弃物转变成重要的化工原料。回答下列问题:
(1)可用NaClO3氧化酸性FeCl2废液得到FeCl3,FeCl3具有净水作用,但腐蚀设备。
①写出NaClO3氧化酸性FeCl2的离子方程式:__________________________。
②若酸性FeCl2废液中:c(Fe2+)=2.0×10-2 mol∕L,c(Fe3+)=1.0×10-3 mol∕L,c(Cl-)=5.3×10-2 mol∕L,则该溶液的c(H+)约为_________。
③与明矾净水原理相似,FeCl3净水的原理是:________________(用恰当文字回答)
(2)可用废铁屑为原料,按下图的工艺流程制备聚合硫酸铁(PFS),PFS是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
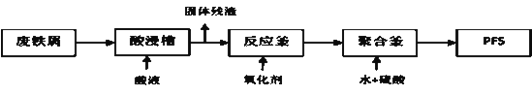
①酸浸时最合适的酸是______________。
②反应釜中加入的氧化剂,下列试剂中最合适的是____________(填标号)。
a.HNO3 b.KMnO4 c.Cl2 d.H2O2
③检验其中Fe2+是否完全被氧化,可选择__________(填标号)。
a.KMnO4溶液 b.Na2SO3溶液 c.KSCN溶液
【答案】ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 10-2mol/L FeCl3在自然水中能生成Fe(OH)3胶体,Fe(OH)3胶体粒子能吸附水中的悬浮杂质 硫酸 d a
【解析】
(1)①NaClO3氧化酸性FeCl2,Cl元素的化合价从+5价降低到-1价,而Fe元素的化合价从+2价升高到+3价,结合守恒规律写出反应的离子方程式;
②根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)计算;
③Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;
(2)废铁屑在酸浸槽中加入酸,酸浸时加入的酸能腐蚀Fe且不能引进杂质,根据PFS成分知,酸为硫酸;然后过滤,向滤液中加入氧化剂,氧化剂能氧化亚铁离子且不能引进新的杂质,选取双氧水;然后向聚合釜中加入水和硫酸,最后得到PFS,结合氧化还原反应的规律分析解答。
(1)①NaClO3氧化酸性FeCl2,反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,而Fe元素的化合价从+2价升高到+3价,根据得失电子守恒和电荷守恒,反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
②根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2molL-1, 故答案为:1.0×10-2 mol/L;
③Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,水解离子方程式为Fe3++3H2O3H++Fe(OH)3,可起到净水的作用,
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,水解离子方程式为Fe3++3H2O3H++Fe(OH)3,可起到净水的作用;
(2)①根据实验目的制备聚合硫酸铁(PFS),酸浸时最合适的酸是稀硫酸,这样可以防止带入新的杂质,故答案为:稀硫酸;
②反应釜中加入氧化剂的作用是将Fe2+转化为Fe3+,最合适的是H2O2,这是因为利用过氧化氢做氧化剂不会带入新的杂质,故答案为:d;
③Fe2+完全被氧化为Fe3+,则溶液中不存在Fe2+,故选择KMnO4溶液检验,向溶液中滴加KMnO4溶液,高锰酸钾溶液不褪色,即可证明完全被氧化,故答案为:a。


科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
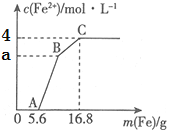
A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法合理的是
①根据纯净物中是否含氧元素,来判断是否属于氧化物
②根据电泳现象可证明胶体带电荷
③直径介于lnm~l00nm之间的微粒称为胶体
④金属氧化物都是碱性氧化物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液
⑥同一钢笔使用不同牌号的墨水容易堵塞,是由于胶体的聚沉
A. 只有⑥ B. 只有②⑥ C. 只有③④⑤ D. 只有①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol SiO2中含有Si-O键为4NA
B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物, B溶于水得蓝色溶液,E为红棕色粉末,它们有如下图所示的关系(反应中生成的水已略去)。

试回答下列问题。
(1)推断填写物质化学式:A是________ ,E是_________,H是_________。
(2)F的类别是_________(选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应④的化学方程式为___________________________________。若反应④转移电子数目为4NA,则生成F______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是NO![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A________________,C_______________。
(2)写出盐酸与D反应的离子方程式:_________________________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有()
A.CO2、NO2均为酸性氧化物,CaO、Na2O2均为碱性氧化物
B.Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应和复分解反应来制取Fe(OH)3
C.灼热的炭与CO2反应、![]() 与
与![]() 的反应均可设计成原电池
的反应均可设计成原电池
D.电解、电泳、电离、电镀、电化学腐蚀过程均需要通电才能发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com