
【题目】废物的处理、转化和利用是非常有意义的。某研究性学习小组设计如图所示流程,综合处理某工厂印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)和废气(H2S),真正做到了变废为宝:处理废液、废气得到氯化铜、单质硫的同时,还实现了蚀刻液的循环利用。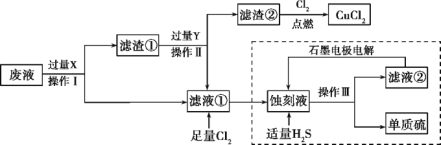
根据以上信息回答下列问题:
(1)操作I、Ⅱ、Ⅲ相同,名称是__,所需要的玻璃仪器主要有:烧杯、玻璃棒、__。
(2)通常用来检验蚀刻液中金属阳离子的化学试剂是__。
(3)向废液中加入过量X时发生的主要反应的离子方程式为__。
(4)滤渣①与Y反应的化学方程式为____。
(5)H2S通入蚀刻液中发生的主要反应为___。
(6)电解池中H+在阴极放电产生H2,阳极的电极反应式为__。
(7)综合分析虚线框内所涉及的两个反应,可知该过程有两个显著优点:①蚀刻液得到循环利用;②__。
【答案】过滤 漏斗 KSCN溶液 2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu Fe+2HCl=FeCl2+H2↑ 2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+ 2Fe2+-2e-=2Fe3+ 硫化氢的原子利用率为100%
【解析】
根据流程图,滤液①中通入足量的氯气,能够生成蚀刻液(FeCl3),因此滤液①为FeCl2,则废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的X为铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,经过过滤得到滤渣①为铜与铁,滤液①为氯化亚铁溶液,滤渣①中加入过量的Y得到氯化亚铁溶液,因此Y为盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,过滤得到滤渣②为铜,铜与氯气反应生成氯化铜,滤液①通入足量氯气生成氯化铁,氯化铁与硫化氢反应生成硫单质和氯化亚铁,过滤得到单质硫和滤液②为氯化亚铁,电解可以生成氯化铁。据此分析解答。
(1)由流程图可知,操作Ⅰ、Ⅱ、Ⅲ都是分离固体与液体的操作,应为过滤操作,用到的玻璃仪器主要有:烧杯、玻璃棒、漏斗,缺少的仪器为:漏斗,故答案为:过滤;漏斗;
(2)滤渣②与氯气反应得到氯化铜,则滤渣②为铜,氯化铁与铜反应生成氯化铁和氯化铜,所以刻蚀液主要为三氯化铁,检验三价铁离子,可以用KSCN溶液,如果加入KSCN溶液出现血红色,证明含有三价铁离子,故答案为:KSCN溶液;
(3)根据上述分析,X为铁,铁能够与溶液中三价铁离子,铜离子发生反应,离子方程式依次是:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu,故答案为:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu;
(4)滤渣①为铜和过量的铁,除去铁,应加入过量的盐酸,所以Y为盐酸,铜与盐酸不反应,铁与盐酸反应生成氯化亚铁,反应的化学方程式:Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(5)刻蚀液为氯化铁,通入硫化氢发生氧化还原反应,反应的化学方程式为:,离子方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl,故答案为:2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+;
(6)氯化铁与硫化氢反应生成硫单质和氯化亚铁、氯化氢,过滤得到滤渣为硫单质,滤液为氯化亚铁和盐酸,电解二者的混合物,阳极上Fe2+失去电子发生氧化反应生成Fe3+,电极反应式为:2Fe2+-2e-=2Fe3+,故答案为:2Fe2+-2e-=2Fe3+;
(7)依据氯化铁与硫化氢反应可知硫化氢在反应中原子利用率为100%,故答案为:硫化氢的原子利用率为100%。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16:7:6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为________;相同条件下的体积之比为________。
(2)标准状况下,1.7 g NH3的体积为________L,它与标准状况下________L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为______,R的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化符合图示的是( )
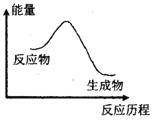
①KMnO4分解制O2 ②铝与盐酸的反应
③钠与水反应 ④二氧化碳与灼热的木炭反应
⑤Ba(OH)2·8H2O和NH4Cl的反应.⑥硫酸与氢氧化钾的反应
A. ②④⑥B. ②③⑤C. ②③⑥D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业金属钛冶炼过程中有一步将原料金红石转化,其反应方程式为:TiO2(金红石)+2C+2Cl2=TiCl4+2CO
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是___。
(2)请写出金红石转化的热化学方程式___。
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:
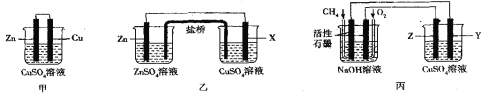
(1)甲装置中铜电极上的电极反应式为___。
(2)放电时盐桥中的Cl-将会出现在乙装置__(填“左”或“右”)侧的容器中,X电极的成分不可能是__(填字母)
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是__(填“Y或Z”),负极上的电极反应式为___。
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
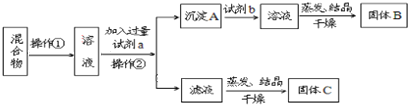
(1)操作①的名称是___________,操作②的名称是____________。
(2)试剂a是___________试剂b是___________,固体B是___________。(填化学式)
(3)加入试剂a所发生的离子方程式为:______________________。加入试剂b所发生的离子方程式为:_____________________。
(4)该方案能否达到实验目的:_______.若不能,应如何改进(若能,此问不用回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
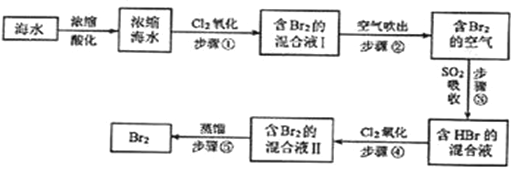
请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com