
【题目】充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是

A. 反应前后装置内空气的成分保持不变
B. 反应前装置内钠与Ag2O物质的量之比为2:1
C. 热稳定性:生成的钠的氧化物强于Ag2O
D. 反应后有淡黄色固体生成
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)9.8gH2SO4的物质的量是;2.0molH2O的质量是 .
(2)含Al3+5.4g的硫酸铝的物质的量为 , 其中含SO42﹣个.
(3)某二价金属1.6g在氧气中完全燃烧生成2g氧化物,则该金属的相对原子量 .
(4)6.02×1023个CO2与molH2质量相等,与gSO2含有的氧原子数相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水的c(H+)=2×10- 7 mol·L-1,则此时c(OH-)为______;若温度不变,滴入稀盐酸使c(H+)=5×10- 4 mol·L-1则溶液中由水电离产生的c(H+)为______,此时温度______(填“高于”、“低于”或“等于”)25℃。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-242.0 kJ/mol
O2(g)===H2O(g) ΔH2=-242.0 kJ/mol
③CO(g)+![]() O2(g)===CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)===CO2(g) ΔH3=-283. 0 kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
_________________________________________________。
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为______。(溶液体积变化忽略不计)
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为(H2PO4- 、HPO42- 、PO43- 、OH- 和H +)___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验). 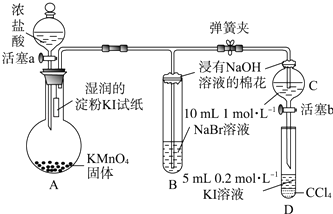
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)A中产生黄绿色气体,其电子式是 .
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.NaClO能使蛋白质变性,可用于配制消杀剂
B.Na2CO3易溶于水,可用于去除餐具表面油污
C.FeCl3水解显酸性,可用于催化H2O2的分解
D.醋酸具有挥发性,可用于溶洗热水器内水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)![]() 2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A. 混合气体的密度保持不变 B. 容器内B、C的浓度之比为2∶1
C. B的生成速率等于C的消耗速率 D. 气体的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有关零排放车载燃料电池叙述正确的是( ) 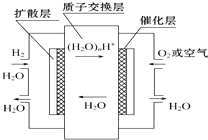
A.正极通入H2 , 发生还原反应
B.负极通入H2 , 发生还原反应
C.总反应式为2H2+O2=2H2O
D.导电离子为质子,且在电池内部由正极定向移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入等物质的量的A 和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:

下列说法中正确的是
A. 30 min~40 min 之间该反应使用了催化剂
B. 反应方程式中的x=2,正反应为吸热反应
C. 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度
D. 前20 min A 的平均反应速率为0.08 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素(其水溶液呈酸性),结构如下图所示。人体缺乏这种维生素C易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500 mg/L左右。下列关于维生素C的叙述错误的是 ( )

A. 维生素C能使溴水褪色
B. 维生素C特别容易失去电子,是较强的还原剂
C. 维生素C可发生水解反应
D. 维生素C不能发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com