
科目: 来源: 题型:
【题目】如下图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡。合金中铁和银的质量比为( )
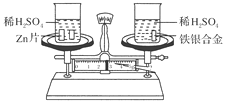
A.65 ∶56B.56 ∶108
C.56 ∶9D.65 ∶9
查看答案和解析>>
科目: 来源: 题型:
【题目】根据提供的情境书写指定反应的方程式。
(1)工业上以碳酸锰矿(主要成分为MnCO3,另含少量FeO、Fe2O3、CaO等杂质)为主要原料生产二氧化锰的工艺流程如下:
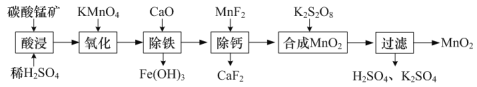
①“酸浸”时MnCO3发生反应的离子方程式为______。
②“氧化”时MnO![]() 转化为Mn2+,该反应的离子方程式为_____。
转化为Mn2+,该反应的离子方程式为_____。
③“合成MnO2”的化学方程式为______。
(2)氮氧化物是造成大气污染的重要因素。
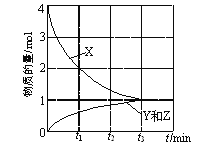
①在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分的物质的量随时间变化曲线如图所示。NO分解的化学方程式为______。
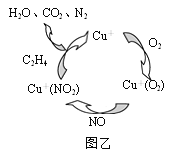
②一种以乙烯作为还原剂的脱硝(NO)机理示意图如图所示,该脱硝机理总反应的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中相关物质的信息都正确的一项是( )
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A |
|
| 不稳定,易分解 | 医用消毒剂 |
B |
| 离子键、共价键 | 强氧化性 | 消毒液 |
C |
| 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D |
| 离子键 | 受热易分解 | 泡沫灭火器 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
①写出NO2和NH3反应生成N2和液态水的热化学反应方程式______。
②反应Ⅰ中各物质所含化学键键能总和数据如下表,a=______。
物质 | N2 | O2 | NO |
每摩尔物质所含键能总和/kJ·mol-1 | 946 | 498 | 630 |
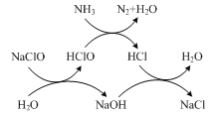
(2)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为______。
(3)某微生物膜技术能利用电解原理将弱碱性水中的NO![]() 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
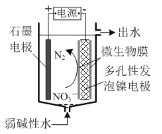
①写出阴极的电极反应式:______。
②理论上,若除去0.04 mol NO![]() ,阳极生成气体的体积为______。(标准状况)
,阳极生成气体的体积为______。(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】用电镀锡渣(主要含![]() 、
、![]() )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
)联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:

已知:①![]() 易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡![]() ;②在水溶液中,
;②在水溶液中,![]() 易被氧化为
易被氧化为![]() 。
。
请回答下列问题:
(1)锡在周期表中的位置为___________。
(2)已知反应I得到的沉淀是![]() ,产生气体的结构式为_____,反应的化学方程式为_______。
,产生气体的结构式为_____,反应的化学方程式为_______。
(3)图中滤液的主要成分为_______________、_______________(写化学式)。
(4)酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:______________。
(5)电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是地球上取之不尽用之不竭的碳源,捕集、利用 CO2 始终是科学研究的热点。
⑴新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。
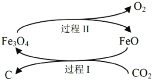
①整个过程中 FeO 的作用是_____________;
②写出 CO2 转化为炭黑的总反应化学方程式_____________。
⑵由CO2 合成甲醇是CO2资源化利用的重要方法。
研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_______。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
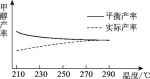
②研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH____0(填“>”或“<”),其依据是_______。
⑶工业用二氧化碳加氢可合成乙醇:![]() 保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比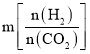 的关系如图所示。
的关系如图所示。
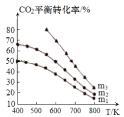
①该反应平衡常数的表达式为_________________。
②投料比m1、m2、m3由大到小的顺序为 _________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
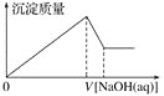
A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。Cu和Zn在元素周期表中位于_____区,请写出基态Cu原子的价电子排布式_______________。第一电离能Il(Zn)_______Il(Cu)(填“大于”或“小于”),原因是________。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式,请分析1个松脂酸铜中π键的个数是______,加“*”碳原子的杂化方式为________。
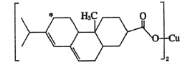
(3)硫酸铜溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
①在[Cu(NH3)4]2+中Cu2+、NH3之间形成的化学键为____,提供孤电子对的成键原子是______。
②![]() 立体构型是_____________。
立体构型是_____________。
③NH3的沸点 _________(填“高于”或“低于”)PH3;
(4)一种铜镍合金(俗称白铜)的晶胞如下图所示,铜、镍原子个数比为__________。
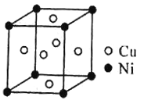
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:
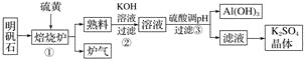
据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com