
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。Cu和Zn在元素周期表中位于_____区,请写出基态Cu原子的价电子排布式_______________。第一电离能Il(Zn)_______Il(Cu)(填“大于”或“小于”),原因是________。
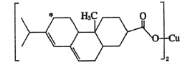
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式,请分析1个松脂酸铜中π键的个数是______,加“*”碳原子的杂化方式为________。
(3)硫酸铜溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
①在[Cu(NH3)4]2+中Cu2+、NH3之间形成的化学键为____,提供孤电子对的成键原子是______。
②![]() 立体构型是_____________。
立体构型是_____________。
③NH3的沸点 _________(填“高于”或“低于”)PH3;
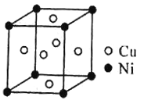
(4)一种铜镍合金(俗称白铜)的晶胞如下图所示,铜、镍原子个数比为__________。
【答案】ds 3d104s1 大于 Zn核外电子排布为全满结构,难失去电子 6 sp3 配位键 N(或氮原子) 正四面体 高于 3:1
【解析】
(1)Cu原子核外有29个电子,其3d、4s电子为其外围电子,所以Cu的价层电子排布式3d104s1;铜和锌分别位于第四周期第ⅠB、ⅡB族,属于ds区。轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子,则第一电离能Cu<Zn。
(2)1个松脂酸铜中含有6个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化;
(3)①N原子提供孤电子对、Cu原子提供空轨道,二者形成配位键,提供孤电子对的成键原子是N。
②硫酸根离子中S原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断微粒空间构型为正四面体形;
=4且不含孤电子对,根据价层电子对互斥理论判断微粒空间构型为正四面体形;
③氨气中能形成分子间氢键、磷化氢分子之间不能形成氢键,所以氨气熔沸点较高;
(4)根据晶胞结构,镍位于顶点,铜位于面心,则晶胞中镍原子的数量为![]() ,铜原子的数量为
,铜原子的数量为![]() ,故铜、镍原子个数比为3:1。
,故铜、镍原子个数比为3:1。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】目前的锂离子电池的正极材料多是LiCoO2、LiMn2O4、LiFePO4和双离子传递型聚合物等。改良正极材料的性能是锂离子电池领域的重点方向,如用碳包覆LiFePO4和向其中掺杂金属银等。下列过程是制备该正极材料的流程图:
![]()
回答下列问题:
(1)LiFePO4中铁元素的化合价为_____价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,C6H12O6的用量占原料总质量的5%。若原料的质量为1000 g,则需要称取NH4H2PO4的质量为_______(保留两位小数)。
(2)将原料先行研磨4 h目的是_________。为了更快得到前驱体粉末,除了保持温度在50℃外,还应进行的常见操作方法是_________。
(3)两次焙烧均需要在高纯氮气环境下进行,原因是________。葡萄糖分解产生的碳除了提供还原性环境,提高产物纯度,而且可以阻止晶粒的聚集长大,控制颗粒形状,提高LiFePO4的电导率。则葡萄糖分解的化学反应方程式(分解过程中只有C一种单质生成)为________。600℃加热时硝酸银发生分解生成红棕色气体和3种常见单质(其中两种气体单质物质的量比为2:7),则分解时的化学反应方程式为_______。
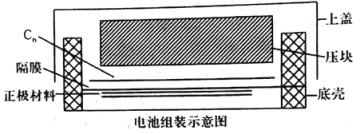
(4)如图所示是用LiFePO4/Ag/C作正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是______、______(锂离子电池是靠xLi+在两极的嵌入和嵌出进行工作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A. 78g苯中含有的碳碳双键的数目为3NA
B. 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C. 将1mol H2与 1 mol I2充入一密闭容器中充分反应后,转移的电子书为2NA
D. 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是
A.小苏打溶液中:c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
B.CH3COONa溶液中:c(CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
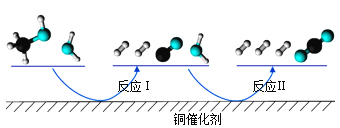

下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中相关物质的信息都正确的一项是( )
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A |
|
| 不稳定,易分解 | 医用消毒剂 |
B |
| 离子键、共价键 | 强氧化性 | 消毒液 |
C |
| 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D |
| 离子键 | 受热易分解 | 泡沫灭火器 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(AlP)熏蒸杀虫,AlP遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05mg·kg-1为合格。某小组同学用如图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100g原粮,E中加入20.00mL 2.50×10-4mol·L-1 KMnO4溶液(H2SO4酸化),向C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
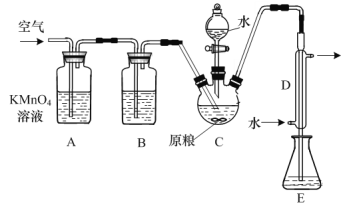
(1)反应后继续通入空气的作用是_______。
(2)装置B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的_______(填化学式)。
(3)装置E中PH3被氧化成磷酸,MnO![]() 被还原为Mn2+,则PH3和MnO
被还原为Mn2+,则PH3和MnO![]() 反应的物质的量之比为_______。
反应的物质的量之比为_______。
(4)收集装置E中的吸收液,加水稀释至250mL,移取其中的25.00mL于锥形瓶中,用6.0×10-5mol·L-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00 mL,反应原理是:SO![]() +MnO
+MnO![]() +H+= SO
+H+= SO![]() +Mn2++H2O(未配平)。通过计算判断该样品是否合格(写出计算过程)_____。
+Mn2++H2O(未配平)。通过计算判断该样品是否合格(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的

A.Cu为正极,Ag2O为负极
B.电池工作时,OH—向正极移动
C.正极的电极反应为:2Cu+2OH——2e—=Cu2O+H2O
D.外电路中每通过2mol电子,正极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( )
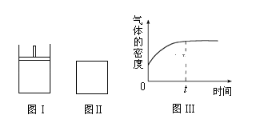
A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com