
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( )
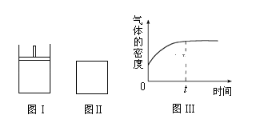
A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
【答案】B
【解析】
A. 设X的变化量为2x
2X(?)+ Y(?) aZ(g)
起始量 2mol 2mol 0
变化量 2x mol x mol ax mol
平衡量 (2-2x) mol (2-x)mol ax mol
依题意得 (2-2x) : (2-x) : ax = 1:3:2
从而求得:x=0.8mol a=1
故物质Z的化学计量数a=1,错误;
B. 若Ⅱ中气体的密度如图Ⅲ所示,分析图中信息可以发现,在 “0”点,气体密度不为0,说明X、Y中至少有一种为气态;从“0”点到“t”点,气体的密度增大,若X、Y都为气体,则气体的密度不变,与图中信息不符,所以X、Y中只有一种为气态,B正确;
C. Ⅱ为恒容容器,Ⅰ为恒压容器,若X、Y均为气态,则Ⅰ相当于Ⅱ加压,平衡正向移动, X的转化率增大,故有Ⅰ>Ⅱ,C错误;
D. 若X为固态、Y为气态,则反应前后气体分子数相等,平衡时Ⅰ、Ⅱ的体积相同,气体的压强相同,从开始到平衡所需的时间:Ⅰ=Ⅱ,D错误。
故答案为B。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O2H++Cl﹣+ClO﹣
B. 向FeSO4溶液中加入H2SO4酸化的KMnO4溶液:5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
C. 向少量澄清石灰水中加入足量的NaHCO3溶液:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
D. 用铜做电极电解NaCl溶液:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
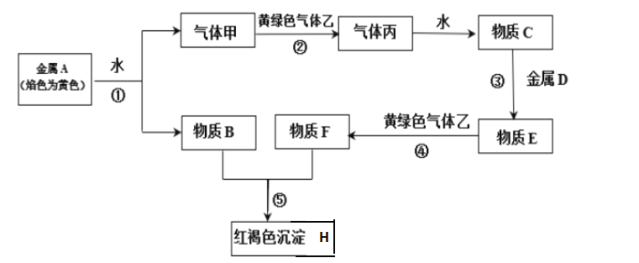
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六组物质,请按要求选择合适的字母编号填空:
A.O2和O3;B.![]() C和
C和![]() C;C.CH3―CH2―CH2―CH3和CH3―CH(CH3)CH3;D.冰醋酸和乙酸;E.甲烷和庚烷;F.淀粉和纤维素
C;C.CH3―CH2―CH2―CH3和CH3―CH(CH3)CH3;D.冰醋酸和乙酸;E.甲烷和庚烷;F.淀粉和纤维素
(1)互为同位素的是___;
(2)属于同系物的是___;
(3)互为同素异形体的是___;
(4)互为同分异构体的是___;
(5)属于同一物质的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。根据如图转化关系完成下列各题:
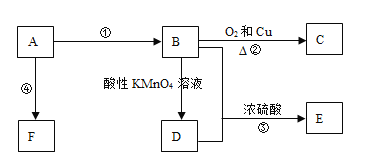
(1)A的分子式是__,C的名称是__,F的结构简式是__。
(2)D分子中的官能团名称是__,请设计一个简单实验来验证D物质存在该官能团,其方法是__。
(3)写出反应②的化学方程式并指出③的反应类型:
反应②:__;反应③类型是__反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化
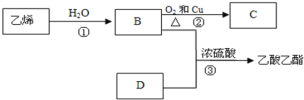
(1)乙烯的结构简式为:__________
(2)写出D化合物中官能团:________;
(3)写出下列反应的化学方程式并注明反应类型。
①______________________,反应类型:______________
②_______________________,反应类型:______________
③______________________,反应类型:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化反应之一:NO(g)+CO(g)![]()
![]() N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
A. 及时除去二氧化碳,正反应速率加快
B. 混合气体的密度不变是该平衡状态的标志之一
C. 降低温度,反应物的转化率和平衡常数均增大
D. 其它条件不变,加入催化剂可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、M、Y、Z是元素周期表前四周期的五种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn(m≠n),M的基态原子2p能级有1个单电子;
③Q、X原子p轨道的未成对电子数都是2。
回答下列问题:
(1)Z在周期表中的位置_______。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为____(用对应元素的符号填写)。
(3)Q、Y分别与X形成的化合物AB2中沸点较高的是___(填写化学式),原因是______。
(4)X、M两元素形成的化合物XM2的VSEPR模型名称为______,已知XM2分子的极性比水分子的极性弱,其原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com