
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
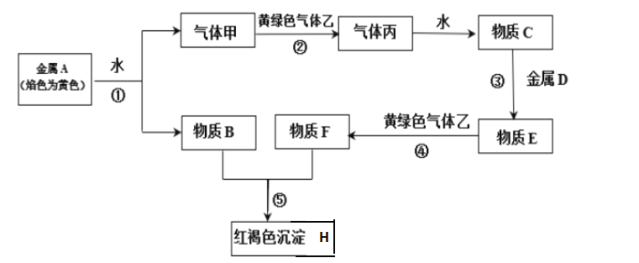
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
【答案】Na NaOH HCl FeCl3 Fe(OH)3 Cl2 2Fe2++Cl2=2Fe3++2Cl- Fe3++3OH=Fe(OH)3↓ 0.05
【解析】
根据转化关系分析可知,金属A的焰色为黄色,所以A为Na,A与水生成气体甲(H2)和物质B(NaOH),气体甲和黄绿色气体乙(Cl2)反应生成气体丙(HCl),丙溶于水形成物质C盐酸;因为金属D最终会和氢氧化钠生成红褐色沉淀H,所以D为Fe,物质E为氯化亚铁,物质F为氯化铁,红褐色沉淀H为氢氧化铁,据此分些解答。
(1)根据上述分析,A为Na,B为NaOH,C为HCl,F为FeCl3,H为Fe(OH)3,乙为Cl2,故答案为:Na;NaOH;HCl;FeCl3;Fe(OH)3;Cl2;
(2)反应④为氯化亚铁被氯气氧化成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,反应⑤为氯化铁和氢氧化钠反应生成氢氧化铁,反应的离子方程式为Fe3++3OH=Fe(OH)3↓,故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3OH=Fe(OH)3↓;
(3)金属Fe与稀硫酸反应的化学反应方程式为Fe+H2SO4===FeSO4+H2↑,标准状况下1.12LH2的物质的量为![]() ,则产生标准状况下1.12L(0.05mol)的H2,参加反应的硫酸为0.05mol,故答案为:0.05。
,则产生标准状况下1.12L(0.05mol)的H2,参加反应的硫酸为0.05mol,故答案为:0.05。


科目:高中化学 来源: 题型:
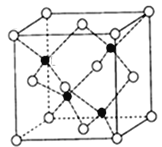
【题目】镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布图为_____。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是____________。
(3)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,同时得到一种最简单的有机物,写出该反应的方程式为_____;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm(1pm=10-12m),则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
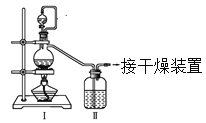
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
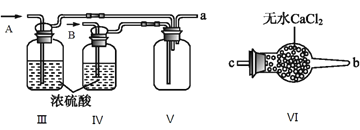
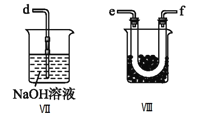
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是( )
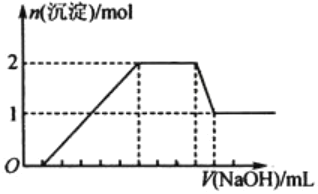
A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+)∶c(Al3+)∶c(Mg2+)=1∶1∶2
D.溶液中![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1 mol该烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4 L,同时得到16.2 g水。
(1)该烃的摩尔质量为________。
(2)该烃的分子式为________。
(3)该烃有一种可能的结构为  ,属于________(选填序号)。
,属于________(选填序号)。
A.环烃 B.烷烃 C.芳香烃 D.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
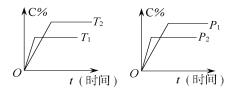
A. 平衡后,使用催化剂,C%将增大
B. 平衡后,增加A的量有利于化学平衡向正反应方向移动
C. 方程式中n>p+q
D. 平衡后,升温,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生如下反应:2A(g)+B(g)![]() 3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol·L-1。下列说法中正确的是( )
3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol·L-1。下列说法中正确的是( )
A.用物质A表示该反应的平均速率为0.2mol·L-1·s-1
B.用物质B表示该反应的平均反应速率为0.2mol·L-1·s-1
C.平衡时物质A与B的转化率相等
D.平衡时物质B的浓度为0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,开始时容器的体积均为VL,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+Y(?)aZ(g)此时Ⅰ中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是( )
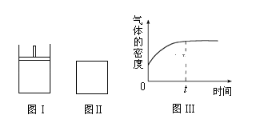
A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )
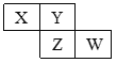
A. Y的价层电子排布式可能是ns2np4
B. 四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
C. Y、Z之间可形成离子化合物
D. X、Z、W的最高价氧化物所对应的水化物可能都是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com