
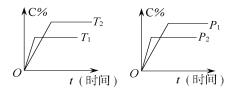
【题目】可逆反应mA(固)+nB(气)![]() pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
A. 平衡后,使用催化剂,C%将增大
B. 平衡后,增加A的量有利于化学平衡向正反应方向移动
C. 方程式中n>p+q
D. 平衡后,升温,平衡向逆反应方向移动
【答案】D
【解析】
可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T1>T2,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<P+q,据此结合外界条件对化学平衡的影响分析解答.
可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短。由图象(1)可知T1>T2,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短。由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<P+q;A.催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故A错误;B.A为固体,浓度为定值,达平衡后,增加A的量,平衡不移动,故B错误;C.由上述分析可知,可逆反应mA(固)+nB(气)Pc (气)+qD(气)正反应为气体物质的量增大的反应,即n<P+q,故C错误;D.由上述分析可知,可逆反应mA(固)+nB(气)Pc (气)+qD(气)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故D正确;故答案为D。


科目:高中化学 来源: 题型:
【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为___________。
(2)制取氢氧化铜的化学方程式为______________________。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu Ⅱ.Cu2O Ⅲ. ______________________。
(进行实验)
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:____________________ |
②过滤、洗涤、干燥。 | 得红色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是( )
①CH3CH2CH2Br在碱性溶液中水解
②甲苯在催化剂作用下与Cl2发生苯环上的取代反应
③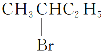 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
④![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
A. ①②B. ①③
C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是___________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
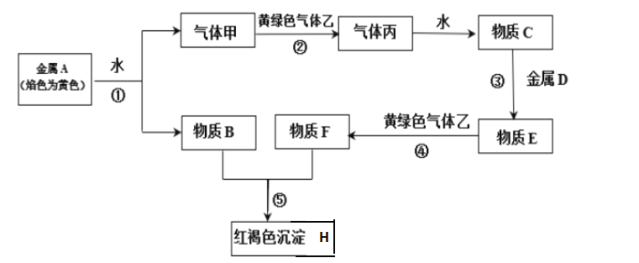
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
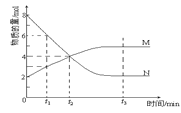
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六组物质,请按要求选择合适的字母编号填空:
A.O2和O3;B.![]() C和
C和![]() C;C.CH3―CH2―CH2―CH3和CH3―CH(CH3)CH3;D.冰醋酸和乙酸;E.甲烷和庚烷;F.淀粉和纤维素
C;C.CH3―CH2―CH2―CH3和CH3―CH(CH3)CH3;D.冰醋酸和乙酸;E.甲烷和庚烷;F.淀粉和纤维素
(1)互为同位素的是___;
(2)属于同系物的是___;
(3)互为同素异形体的是___;
(4)互为同分异构体的是___;
(5)属于同一物质的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
实验方案 | 现象 | 结论 |
步骤1:取4mL①__________ mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
步骤2:取4mL②__________mol/LFeSO4 溶液向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除CO。已知:
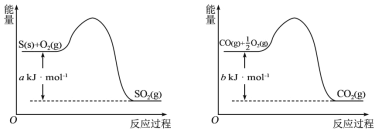
则用SO2除去CO的热化学方程式为___。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示:
)的废水可以利用微生物电池除去,其原理如图所示:
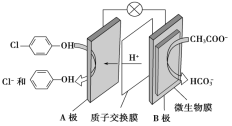
①B是电池的___极(填“正”或“负”);
②A极的电极反应式为____。
(3)利用双模三室电解法不仅可处理含NiCl2的废水,还可回收金属镍,其装置如图所示。
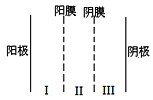
①两端电解质溶液分别为含NiCl2的废水和NaOH溶液,其中含NiCl2的废水应进___(填“Ⅰ”“Ⅱ”“Ⅲ”,下同)室。
②阳极的电极反应式为___。
(4)某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol·L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。
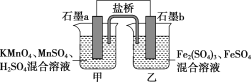
回答下列问题:
①此原电池的正极是石墨___(填“a”或“b”),发生___反应。
②电池工作时,盐桥中的SO42-移向____(填“甲”或“乙”)烧杯。
③甲烧杯中的电极反应式为____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com