
【题目】(1)镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除CO。已知:
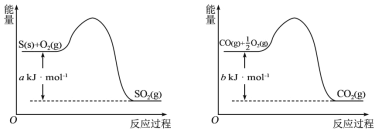
则用SO2除去CO的热化学方程式为___。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示:
)的废水可以利用微生物电池除去,其原理如图所示:
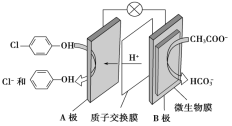
①B是电池的___极(填“正”或“负”);
②A极的电极反应式为____。
(3)利用双模三室电解法不仅可处理含NiCl2的废水,还可回收金属镍,其装置如图所示。
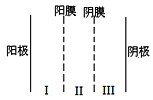
①两端电解质溶液分别为含NiCl2的废水和NaOH溶液,其中含NiCl2的废水应进___(填“Ⅰ”“Ⅱ”“Ⅲ”,下同)室。
②阳极的电极反应式为___。
(4)某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol·L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。
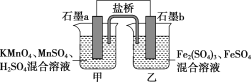
回答下列问题:
①此原电池的正极是石墨___(填“a”或“b”),发生___反应。
②电池工作时,盐桥中的SO42-移向____(填“甲”或“乙”)烧杯。
③甲烧杯中的电极反应式为____;
【答案】SO2(g) +2CO(g) =S(s) +CO2(g) △H=-(2b-a)kJ/mol 负极 ![]() +2e-+H+═
+2e-+H+═![]() +Cl- III 4OH--4e-=O2↑+2H2O a 还原 乙 MnO4-+5e-+8H+=Mn2++4H2O
+Cl- III 4OH--4e-=O2↑+2H2O a 还原 乙 MnO4-+5e-+8H+=Mn2++4H2O
【解析】
(1)依据图示信息可知①S(s)+O2(g)=SO2(g) △H=-akJ/mol,
②CO(g) +![]() O2(g) =CO2(g) △H=-bkJ/mol;
O2(g) =CO2(g) △H=-bkJ/mol;
依据盖斯定律②×2-①得到:SO2(g) +2CO(g) =S(s) +CO2(g) △H=-(2b-a)kJ/mol;
故答案为:SO2(g) +2CO(g) =S(s) +CO2(g) △H=-(2b-a)kJ/mol;
(2)①由氢离子的定向移动可知A为正极,B为负极;
②A为正极,正极上发生得电子的还原反应:![]() +2e-+H+═
+2e-+H+═![]() +Cl-;
+Cl-;
(3)①电解池工作时,阳极发生氧化反应,阴极发生还原反应。由电解的目的知,镍元素从+2价降低为0价,发生还原反应,因此,含NiCl2的废水应在阴极室,即图示装置中的III室;
②Ⅱ室中的溶液为NaOH溶液,电解过程中,Na+通过阴膜迁移到II室,OH-通过阳膜迁移到I室,并在阳极,上发生氧化反应,电极反应式为: 4OH--4e-=O2↑+2H2O;
(4)①根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极;
②电池工作时,SO42-向负极移动,即向乙烧杯移动;
③甲烧杯中的电极为正极,正极上MnO4-得电子产生Mn2+,电极反应式为MnO4-+5e-+8H+=Mn2++4H2O。


科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
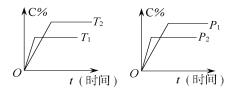
A. 平衡后,使用催化剂,C%将增大
B. 平衡后,增加A的量有利于化学平衡向正反应方向移动
C. 方程式中n>p+q
D. 平衡后,升温,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
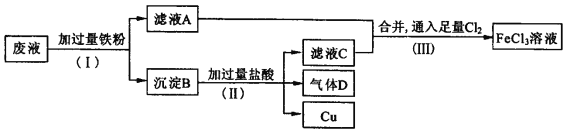
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是____________________;
(2)沉淀B中主要含有铁和__________,气体D是_________________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式_____________;
(4)取少量最终所得溶液滴加___________,溶液呈红色,证明有Fe3+存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A. 2p和3p轨道形状均为哑铃形,能量也相等
B. 氮原子的价电子排布图:![]()
C. 利用手性催化剂合成可得到一种或主要得到一种手性分子,手性异构体性质相同
D. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )
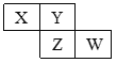
A. Y的价层电子排布式可能是ns2np4
B. 四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
C. Y、Z之间可形成离子化合物
D. X、Z、W的最高价氧化物所对应的水化物可能都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A. 二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
B. lmol环戊二烯(![]() )中含有
)中含有![]() 键的数目为11NA
键的数目为11NA
C. 二茂铁分子中存在π键
D. Fe2+的电子排布式为ls 22s 22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
分离碘的CCl4溶液 | 收集气体 | 分离NaCl和NH4Cl | 验证元素的非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
![]()
Ⅰ.若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
(1)A的电子式为___。
(2)A的催化氧化反应的化学方程式为__。
Ⅱ.若A、C、W都是常见气体,C是导致酸雨的主要气体,常温下A与C反应生成B,
(1)A与C反应生成B的化学方程式为___。
(2)某化学活动小组将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:___。
Ⅲ.A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。则C的化学式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com