
【题目】X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中不正确的是( )
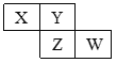
A. Y的价层电子排布式可能是ns2np4
B. 四种元素所形成的氢化物中,沸点最高的可能是Y的氢化物
C. Y、Z之间可形成离子化合物
D. X、Z、W的最高价氧化物所对应的水化物可能都是强酸
【答案】C
【解析】
X、Y、Z、W均为短周期主族元素,由它们在周期表中的相对位置可知,X、Y在第2周期,Z、W在第3周期,若X为碳元素、Y为氮元素,Z为磷元素、W为硫元素;若X为氮元素、Y为氧元素,Z为硫元素、W为氯元素,据此解答。
A、若X为氮元素、Y为氧元素,O的价层电子排布式可能是2s22p4,故A正确;
B、若X为氮元素、Y为氧元素,Z为硫元素、W为氯元素,四种元素所形成的氢化物依次为NH3、H2O、H2S、HCl,Y的氢化物为水,因水中含有氢键,所以四种元素所形成的氢化物中,Y的沸点最高,故B正确;
C、若Y为氮元素,Z为磷元素;若Y为氧元素,Z为硫元素,Y、Z均为非金属元素,Y、Z之间形成共价化合物,故C错误;
D、若X为氮元素、Y为氧元素,Z为硫元素、W为氯元素,X、Z、W的最高价氧化物所对应的水化物依次为HNO3、H2SO4、HClO4,均为强酸,故D正确。
故选C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
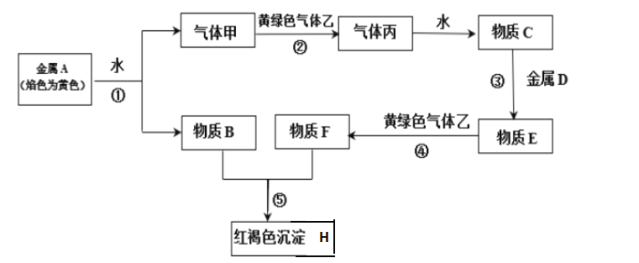
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A________、B_______、C_______、F________、 H_____________、乙_________
(2)写出下列反应的离子方程式:④_____________⑤___________
(3)金属D与稀硫酸反应,产生标准状况下1.12L的H2气体,则参加反应的硫酸为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化
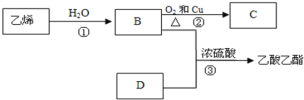
(1)乙烯的结构简式为:__________
(2)写出D化合物中官能团:________;
(3)写出下列反应的化学方程式并注明反应类型。
①______________________,反应类型:______________
②_______________________,反应类型:______________
③______________________,反应类型:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化反应之一:NO(g)+CO(g)![]()
![]() N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反应在恒容的密闭容器中达到平衡状态,下列说法正确的是
A. 及时除去二氧化碳,正反应速率加快
B. 混合气体的密度不变是该平衡状态的标志之一
C. 降低温度,反应物的转化率和平衡常数均增大
D. 其它条件不变,加入催化剂可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

选项 | ①试剂 | ①中现象 | 解释 |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性: H2SO3 >H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成 白色BaSO3沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镍与CO反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2除CO。已知:
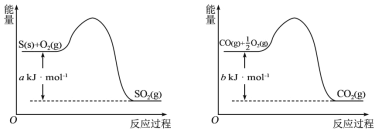
则用SO2除去CO的热化学方程式为___。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示:
)的废水可以利用微生物电池除去,其原理如图所示:
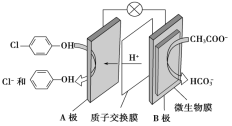
①B是电池的___极(填“正”或“负”);
②A极的电极反应式为____。
(3)利用双模三室电解法不仅可处理含NiCl2的废水,还可回收金属镍,其装置如图所示。
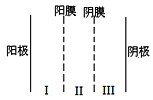
①两端电解质溶液分别为含NiCl2的废水和NaOH溶液,其中含NiCl2的废水应进___(填“Ⅰ”“Ⅱ”“Ⅲ”,下同)室。
②阳极的电极反应式为___。
(4)某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1mol·L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液。
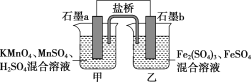
回答下列问题:
①此原电池的正极是石墨___(填“a”或“b”),发生___反应。
②电池工作时,盐桥中的SO42-移向____(填“甲”或“乙”)烧杯。
③甲烧杯中的电极反应式为____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示的实验室制取氨气,下列说法正确的是
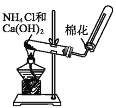
A.发生装置与用 KClO3 制取O2 的装置相同
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐可以是 NH4NO3,所用的碱也可以是 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、M、Y、Z是元素周期表前四周期的五种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn(m≠n),M的基态原子2p能级有1个单电子;
③Q、X原子p轨道的未成对电子数都是2。
回答下列问题:
(1)Z在周期表中的位置_______。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为____(用对应元素的符号填写)。
(3)Q、Y分别与X形成的化合物AB2中沸点较高的是___(填写化学式),原因是______。
(4)X、M两元素形成的化合物XM2的VSEPR模型名称为______,已知XM2分子的极性比水分子的极性弱,其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。

i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________________________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. 100mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是____________________________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________;操作Ⅰ的名称是___________。
iii纯度测定
(4)称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应).重复三次,平均每次消耗KOH溶液的体积23.00mL。样品中苯甲酸纯度为_______。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物。应采用___________法对样品提纯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com