
【题目】下列化学反应的产物中,存在同分异构体的是( )
①CH3CH2CH2Br在碱性溶液中水解
②甲苯在催化剂作用下与Cl2发生苯环上的取代反应
③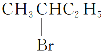 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
④![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
A. ①②B. ①③
C. ③④D. ②③
【答案】D
【解析】
①卤代烃在碱性条件下发生的是水解反应,其实质是卤素原子被羟基取代;
②甲苯在催化剂作用下与Cl2发生取代反应,取代的是苯环上的氢原子;
③根据氯代烃的消去反应实质来判断;
④苯环和碳碳双键均可以被氢气加成,完全加成即均变为单键。
①CH3CH2CH2Br在碱性溶液中水解只能得到CH3CH2CH2OH,无同分异构体,①错误;
②甲苯在催化剂作用下与Cl2发生取代反应,可以取代苯环上的氢原子,苯环上含有三种不同位置的氢原子,因此所得产物存在同分异构体,②正确;
③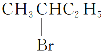 与NaOH的醇溶液共热,发生消去反应生成的烯烃可能是1-丁烯CH2=CHCH2CH3,也可能是2-丁烯CH3CH=CHCH3,有同分异构体,③正确;
与NaOH的醇溶液共热,发生消去反应生成的烯烃可能是1-丁烯CH2=CHCH2CH3,也可能是2-丁烯CH3CH=CHCH3,有同分异构体,③正确;
④苯乙烯与氢气完全加成得到的为乙基环己烷一种产物,无同分异构体,④错误;
存在同分异构体的为②③,故合理选项是D。


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )

A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变.可燃冰是在高压低温环境条件下,水分子笼中装有甲烷分子而成的“冰块”,可直接点燃.己知某种可燃冰的化学式为:CH48H2O.请回答:
(1)这种可燃冰中含有_____种元素:原子个数比:C:H:O=_____;
(2)这种可燃冰中甲烷的质量分数为_____%;936g(约1升)该可燃冰常温下可释放出_____升甲烷(常温下甲烷密度为0.72g/L).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1mol/LNa2SO4溶液中含氧原子的数目一定大于4NA
B. 1L0.1mol/LNa2S溶液中含阴离子的数目小于0.1NA
C. 生成1mol氧化产物时转移电子数为4NA
D. 通常状况下11.2LCO2中含质子的数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
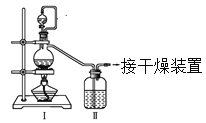
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
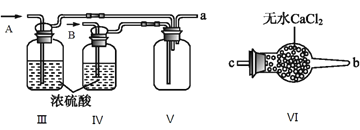
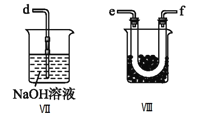
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ______________。
(2)表中元素能形成两性氢氧化物的化学式___________,写出⑦元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ______。
(3)④元素与⑦元素形成化合物的电子式 ___________。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是(填化学式)_____________。
(5)③元素与⑩元素两者核电荷数之差是 _________。
(6)水溶液中⑦的单质可以将⑩的简单离子置换为其单质,写出该反应的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是( )
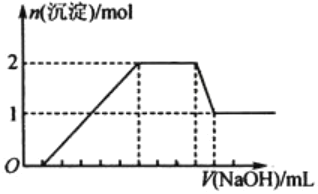
A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+)∶c(Al3+)∶c(Mg2+)=1∶1∶2
D.溶液中![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
pC (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
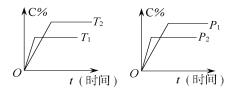
A. 平衡后,使用催化剂,C%将增大
B. 平衡后,增加A的量有利于化学平衡向正反应方向移动
C. 方程式中n>p+q
D. 平衡后,升温,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
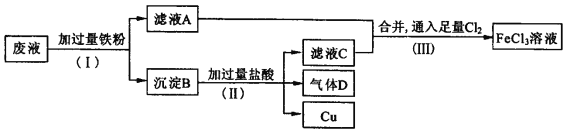
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是____________________;
(2)沉淀B中主要含有铁和__________,气体D是_________________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式_____________;
(4)取少量最终所得溶液滴加___________,溶液呈红色,证明有Fe3+存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com