
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
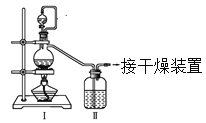
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
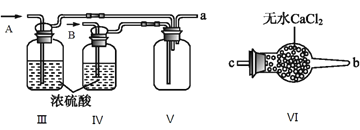
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
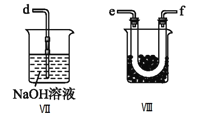
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
【答案】 浓盐酸 饱和食盐水 稀硝酸 水 Cl2 e→f→c→b→d 通过观察气泡调节气体流速 ③ NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)![]() NOCl↑+Cl2↑+2H2O
NOCl↑+Cl2↑+2H2O
【解析】试题分析:本题考查Cl2、NO和NOCl的制备,实验装置的连接,方程式的书写。
(1)制备Cl2的反应原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。①制备Cl2时分液漏斗中盛放浓盐酸。②由于盐酸具有挥发性,上述方法制得的Cl2中混有HCl、H2O(g),为了除去Cl2中的HCl,装置II中盛放饱和食盐水。
MnCl2+Cl2↑+2H2O。①制备Cl2时分液漏斗中盛放浓盐酸。②由于盐酸具有挥发性,上述方法制得的Cl2中混有HCl、H2O(g),为了除去Cl2中的HCl,装置II中盛放饱和食盐水。
制备NO的反应原理为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。③制备NO时分液漏斗中盛放稀硝酸。④因为装置中有空气,制得的NO与O2反应生成NO2,NO中混有NO2,为了除去NO2,装置II中盛放H2O,反应的化学方程式为3NO2+H2O=2HNO3+NO。
(2)①NO的密度小于Cl2的密度,为了使气体充分反应,从短管进入Cl2,从A处进入的气体是Cl2。
②在装置V中NO与Cl2合成NOCl,NOCl是一种黄色气体,沸点为-5.5℃,在装置VIII中将NOCl冷凝,NOCl遇水易水解,在装置VIII后面连接装置VI,由于Cl2、NO、NOCl会污染大气,最后连接装置VII吸收尾气;装置连接顺序为a→e→f→c→b→d。
③装置III、IV除可干燥NO、Cl2外,另一个作用是:通过观察气泡调节气体流速。
④装置VIII的烧杯中盛放的试剂将NOCl冷凝为液体,NOCl的沸点为-5.5℃,应选择冰盐水,答案选③。
⑤NOCl遇水易水解,则NOCl与NaOH溶液反应生成NaNO2、NaCl和H2O,反应的化学方程式为NOCl+2NaOH=NaNO2+NaCl+H2O。
(3)根据资料写出反应HNO3(浓)+HCl(浓)![]() NOCl↑+Cl2↑,N元素的化合价由+5价降至+3价,Cl元素的化合价由-1价升至0价,根据得失电子守恒、结合原子守恒,写出反应的化学方程式为HNO3(浓)+3HCl(浓)
NOCl↑+Cl2↑,N元素的化合价由+5价降至+3价,Cl元素的化合价由-1价升至0价,根据得失电子守恒、结合原子守恒,写出反应的化学方程式为HNO3(浓)+3HCl(浓)![]() NOCl↑+Cl2↑+2H2O。
NOCl↑+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
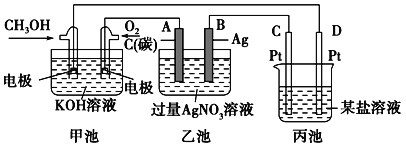
(1)甲池中OH-移向__________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式_______________。
(3)乙池中总反应的离子方程式___________________。
(4)当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如下所示:
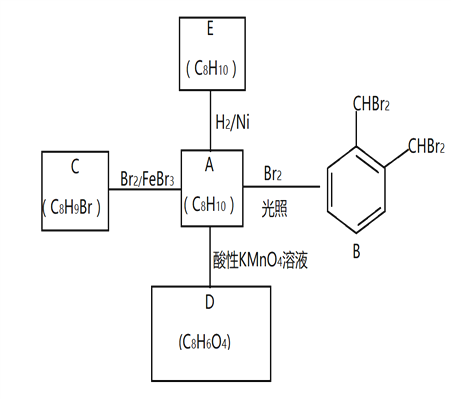
回答下列问题:
(1)A的化学名称是___________
(2)A→B 的反应类型是______________。在该反应的副产物中,与B互为同分异构体的副产物的结构简式为______________________
(3)C中官能团名称_____________;A与酸性KMnO4溶液反应可得到D,写出D中官能团名称_______________________________
(4)A→E的化学方程式为____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973 K | 1173 K | ||
①Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.50 | 2.15 |
②Fe(s)+H2O(g)FeO(s)+H2(g) | K2 | 2.40 | 1.67 |
③CO(g)+H2O(g)CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:
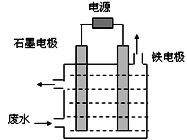
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:![]() .7~10;
.7~10;![]() .10~11;
.10~11;![]() .11~13),解释该pH不宜太大的原因___________________。
.11~13),解释该pH不宜太大的原因___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A. 共价化合物可能含有离子键
B. CCl4和NH3都是只含有极性键的共价化合物
C. Na2O2是含有非极性键的离子化合物
D. CaO和NaCl晶体熔化时要破坏离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中共有18个纵行,但仅有15个族
C.原子的核外电子层数等于该元素所在的周期数
D.原子最外层电子数等于该元素所在的族序数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com