
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
科目:高中化学 来源: 题型:
【题目】某元素位于周期表中的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属元素.此元素可能是( )
A.Si
B.Ge
C.Sn
D.Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
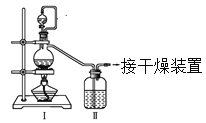
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
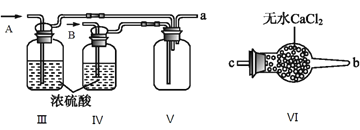
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示。A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6:已知:Mr(R-Cl)-Mr(ROH)=18.5,,Mr表示相对分子质量。
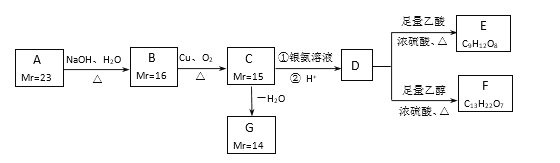
(1)A中含有的官能团符号是_________________。
(2)写出D的分子式____________________________。
(3)下列有关A~G的说法正确的是_____________________。
a.每个A分子中含有官能团的数目为4个 b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物 d.E中含有手性碳原子
(4)写出B生成C的化学方程式______________________________________。
(5)芳香族化合物H与G互为同分异构体, 1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H苯环上的一氯代物只有两种,写出符合条件的H的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如下图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6 min,试管乙不加热。待试管甲中的溶液冷却后再进行后续实验。

实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式: 。
(2)设计甲和乙是为了探究 对淀粉水解的影响,设计甲和丙是为了探究 对淀粉水解的影响。
(3)实验1失败的原因是 。
(4)实验3中溶液的颜色无明显变化的原因是 。
(5)下列结论合理的是 (填字母)。
a.淀粉水解需要在催化剂和一定温度下进行
b.欲检验淀粉是否完全水解,最好在冷却后的水解液中直接加碘
c.欲检验淀粉的水解产物具有还原性,应先在水解液中加入氢氧化钠中和稀硫酸至溶液呈碱性,再加入新制氢氧化铜并加热
d.若用唾液代替稀硫酸,则实验1可能出现预期的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
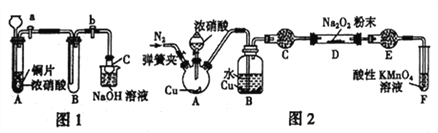
Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2 氧化Na2O2。
(1)甲同学设计如图1装置进行实验:
①试管A 中反应的离子方程式是____________________________。
②待试管B 中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为___________________。
结论:甲同学认为假设2 正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确,则NO2和Na2O2反应的化学方程式是_______________________。
Ⅱ.该研究性学习小组同学还认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________________。
②B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生③C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F 中发生反应的氧化剂与还原剂的物质的量之比为_____________。
⑤充分反应后,检验D装置中产物的方法是:______________ ,则产物是NaNO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
【答案】B
【解析】
NO、CO2的混合气体通过足量的Na2O2发生反应有2Na2O2+2CO2═2Na2CO3+O2、2NO+O2═2NO2,问题的关键在于NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算。
NO、CO2的混合气体通过足量的Na2O2发生反应有(1)2Na2O2+2CO2═2Na2CO3+O2、(2)2NO+O2═2NO2,假设参加反应的CO2为x mL,NO为ymL,则x+y=10,由方程式得以下关系:
①2CO2+ 2Na2O2= 2Na2CO3+ O2
2mL 1mL
xmL ![]() mL
mL
②2NO + O2 = 2NO2
2mL 1mL 2mL
ymL ![]() mL
mL
当反应②恰好反应时,即当y=x时(此时x、y都等于5),生成的NO2的体积为5mL,显然符合题意,A正确;当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL-xmL),生成的NO2气体为xmL,因此反应最后得到的混合气体为NO和NO2,其体积和为(ymL-xmL)+xmL=ymL,结合x+y=10,再根据NO过量的前提条件为y>x,可以得出结论y>5,这与题意“气体体积缩小为5mL”不符,B错误;当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() —
—![]() )mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
)mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() —
—![]() )mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
)mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
【点睛】
本题考查混合物的有关计算,属于讨论型计算,侧重对综合能力的考查,确定反应可能的情况是解答的关键。
【题型】单选题
【结束】
24
【题目】在一定温度和压强下,将一支容积为21mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A. 8.75mL B. 12.25mL
C. 5.25mL D. 10.5mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com