
科目: 来源: 题型:
【题目】电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。实验室模拟流程如图所示:
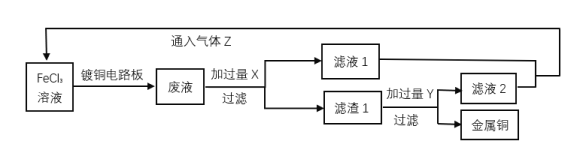
回答下列问题:
(1)过滤操作除铁架台(附铁圈)、烧杯、滤纸外还需要的仪器为___。
(2)滤渣1成分的化学式为___;试剂Y为___。
(3)可替代气体Z的试剂为___(填序号)
A.硝酸 B.酸性高锰酸钾 C.过氧化氢
(4)写出FeCl3溶液腐蚀覆铜板的离子方程式___。
(5)用实验证明滤液1中只含有Fe2+___。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有如下转化关系
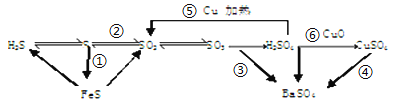
(1)发生氧化还原反应的是___________(填序号)
(2)写出(5)的反应方程式____________,说明浓硫酸具有___________,制取CuSO4,__________方法最好(填序号);
(3)SO2是造成空气污染,形成酸雨的主要物质。SO2在水的存在下与氧气反应生成硫酸,反应方程式为_____________。验证二氧化硫的方法是_____________。
(4)某溶液中含有Cl-、SO42-,可能含有Na+、Fe2+或其中一种。
①验证Cl-、SO42-的方法是______________
A.先加BaCl2溶液,等沉淀后,再加AgNO3溶液
B.先加AgNO3溶液,等沉淀后,再加BaCl2溶液
C.先加Ba(NO3)2溶液,等沉淀后,再加AgNO3溶液
②验证Na+或Fe2+最简单的方法是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化氢中的硫元素化合价为______,在化学反应中易_____(填得或失)电子,因此具有______性。硫化氢可燃,氧气充足情况下,硫化氢燃烧产生淡蓝色火焰,化学方程式_________;氧气不足情况下,硫化氢燃烧化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如下图所示。
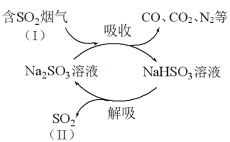
(1)SO2的浓度:I________II(填“>”或“<”)。
(2)在这个过程中可以循环使用的物质是________。
(3)上述吸收过程中主要反应的化学方程式是________。
(4)解吸过程需要加热,在这个过程中常伴有少量SO42-产生。
① 证明产物中含SO42-的实验方法是:取少量解吸产物的溶液,________(填操作和现象)。
② 产生SO42-的原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验测得16 g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:___。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
2NH3(g) ΔH=akJ·mol-1。有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a=____。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的反应热为:ΔH=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:p=p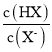 =-lg
=-lg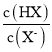 。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )
。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )

A.a点溶液中:c(HX)+c(X-)=0.10mo1·L-1
B.c点溶液中:c(Na+)<10c(HX)
C.b点坐标为(0,4.50)
D.溶液中水的电离程度:c<b<a
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据下图所示,回答下列问题:

已知:氢化物指的是由氢元素和另一种元素组成的化合物,例如NH3就是氮元素的一种氢化物。
(1)X的化学式为________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________。
(3)已知SO3是一种酸性氧化物,则SO3与NaOH溶液反应的离子方程式为_____________。
(4)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_______(填序号)。
A.Na2S+S B.Na2SO3+S
C.Na2SO3+Na2SO4 D.SO2+Na2SO4
(5)将X与Y混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目: 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
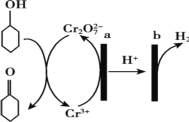
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
查看答案和解析>>
科目: 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
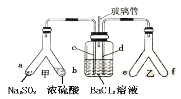
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com