
科目: 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为__;C中官能团的名称是___。
(2)③的反应试剂和反应条件分别是__,该反应类型是__。
(3)T(C7H7NO2)是E在碱性条件下的水解产物的酸化产物,同时符合下列条件的T的同分异构体有__种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为__。
①—NH2直接连在苯环上②能与新制氢氧化铜悬浊液共热产生红色固体
(4)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为__(其他无机试剂任)。
的路线为__(其他无机试剂任)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )
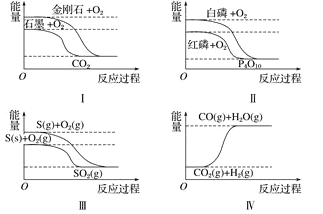
A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+![]() O2(g) === H2O(l) ΔH=—285.8 kJ/mol
O2(g) === H2O(l) ΔH=—285.8 kJ/mol
CH4(g)+2O2(g) === CO2(g)+2H2O(l) ΔH=—890 kJ/mol.
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热2 938.75 kJ。原混合气体中H2与CH4的质量之比大约是 ( )
A.1∶1B.1∶8C.1∶4D.1∶16
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨的反应,根据下列在相同时间内测定的结果判断,化学反应速率最快的是 ( )
A.v(H2)=0.2 mol·L-1·min-1B.v(H2)=0.04 mol·L-1·s-1
C.v(N2)=0.01 mol·L-1·s-1D.v(N2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+
O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+![]() O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
A.172.5 kJB.110.5 kJC.283 kJD.566 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
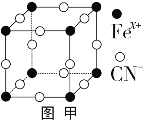
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
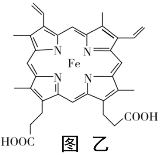
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________
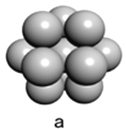
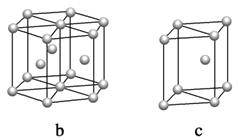
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物在工农业生产和日常生活中有广泛的应用,对其研究具有重要意义。
回答下列问题:
(1)利用活性炭的___作用可去除水中的悬浮杂质。
(2)炭黑可以活化氧分子得到活化氧(O*),活化氧可以快速将SO2氧化为SO3,其活化过程中的能量变化如图所示:
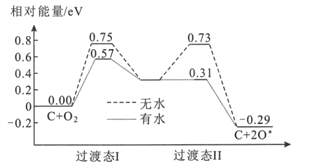
活化过程中有水时的活化能降低了___eV。在酸雨的形成过程中,炭黑起:___作用。
(3)已知:CO(g)+2H2(g)![]() CH3OH(g) H,经测定不同温度下该反应的浓度平衡常数如下:
CH3OH(g) H,经测定不同温度下该反应的浓度平衡常数如下:

①该反应的△H___0(填“>”或“<");250℃时,某时刻测得反应体系中c(CO)=0.4mol·L-1、c(H2)=0.4mol·L-1、c(CH3OH)=0.8mol·L-1,则此时v正__v逆(填“>”、“=”或“<”)。.
②某温度下,在2L刚性容器中,充入0.8molCO和1.6molH2,压强为p,tmin后达到平衡,测得压强为![]() P。则v(H2)=____mol·L-1·min-1,平衡时的Kp=____。
P。则v(H2)=____mol·L-1·min-1,平衡时的Kp=____。
(4)科研人员设计了甲烷燃料电池电解饱和食盐水装置如图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
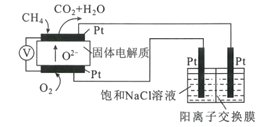
①该电池工作时负极反应方程式为____。
②用该电池电解100mL饱和食盐水,若在两极产生的气体体积分别为V1L、V2L(标准状况),且V1>V2,则电解所得溶液的c(OH-)=____mol·L-1(忽略气体溶解和溶液体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
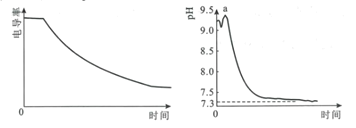
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com