
科目: 来源: 题型:
【题目】下列有关化学原理在工业上的应用,说法正确的是
A.合成NH3时高温和实验室制取NH3加热的原理一样
B.甲烷、乙烯、苯和酯都可通过石油分馏得到
C.电解饱和氯化钠溶液可以制取金属钠
D.可通过反应C+H2O![]() CO+H2制水煤气
CO+H2制水煤气
查看答案和解析>>
科目: 来源: 题型:
【题目】一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。A为含硫氮正盐其中硫元素化合价为+4,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:

(1)写出下列物质化学式:D:__________;F:__________。
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液反应__________;
②D和新制氯水:__________。
(3)通过本题的解答,在检验SO42-时,应使用__________。
A.盐酸酸化的BaCl2溶液 B.硝酸酸化的Ba(NO3)2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是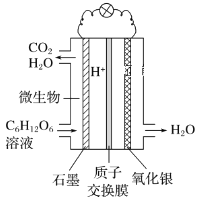
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.每转移4 mol电子,石墨电极产生22.4 L CO2气体
D.每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区
查看答案和解析>>
科目: 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A.x=1
B.2 min内A的反应速率为0.2 mol·L-1·min-1
C.B的转化率为40%
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
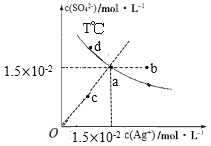
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予了对锂离子电池方面的研究作出贡献的约翰·B·古迪纳夫(John B.Goodenough)等三位科学家。已知可充电镍酸锂离子电池的工作原理如图所示,其总反应为:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
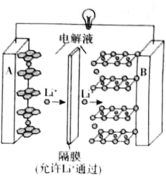
A.放电时,A电极为![]() 作原电池负极
作原电池负极
B.放电时,B电极反应式为![]()
C.充电时,A电极反应式为![]()
D.充电时,当电路中通过![]() 电子的电量时,A、B两极质量变化差为
电子的电量时,A、B两极质量变化差为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
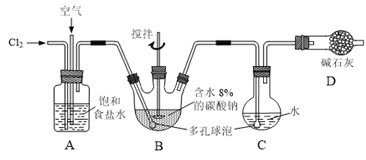
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
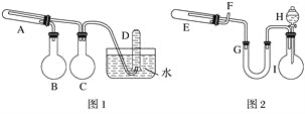
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是____________;烧瓶C的作用是__________;在试管D中收集得到的是__________。
(2)实验时,U形管G中应加入的试剂是____________;长颈漏斗H中应加入____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________________。
(4)试管E中发生反应的化学方程式是__________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须____________;E管中的反应开始后,在F出口处应________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com