
科目: 来源: 题型:
【题目】铁是一种非常重要的金属。
(1)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
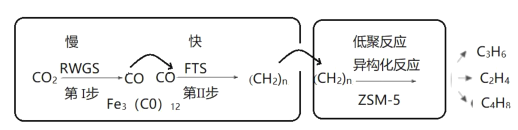
下列说法正确的是___。
A.第ⅰ步反应的活化能低于第ⅱ步
B.第ⅰ步所发生的反应为:CO2+H2![]() CO+H2O
CO+H2O
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
D.保持其他条件不变,添加不同助剂后各反应的平衡常数不变
加入助剂K能提高单位时间内乙烯产量的根本原因是___。
(2)纳米铁是重要的储氢材料,可用反应Fe(s)+5CO(g)![]() Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
Fe(CO)5(g)制得。在1L恒容密闭容器中加入足量铁粉和0.24mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图所示。
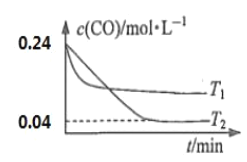
①T1___T2,△H___0(填“>”或“<”)
②已知:标准平衡常数Kθ=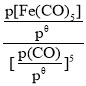 ,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=___(用含p的最简式表示)
,其中pθ为标准压强(1×105Pa),p[Fe(CO)5]、p(CO)为各组分的平衡分压。T2温度下,平衡时体系的压强为p,反应的标准平衡常数Kθ=___(用含p的最简式表示)
(3)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
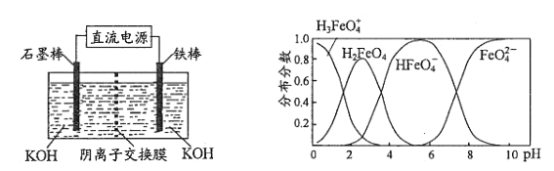
①电解法可制得K2FeO4,装置如图,若转移6mol电子则隔膜右边溶液增重___g。
②K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示,向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为___。
(4)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)=MnFe2O(4-x)(s)+![]() O2(g)△H1
O2(g)△H1
②MnFe2O(4-x)(s)+xH2O(g)=MnFe2O4(s)+xH2(g)△H2
③2H2O(g)=2H2(g)+O2(g)△H3
则:△H3与△H1、△H2的关系为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
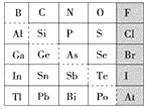
(1)元素Ga在元素周期表中的位置为:第_____周期第____族。
(2)Sn的最高正价为____,Cl的最高价氧化物对应水化物的化学式为___,Bi的最高价氧化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是______元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4______H2SeO4(填“>”“<”或“=”)。
③氢化物的还原性:H2O______H2S(填“>”“<”或“=”)。
④原子半径比较:N______Si(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找______(填序号)。
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)________。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】自门捷列夫绘制第一张元素周期来以来,经过多次的演变,出现了多种形式的元素周期表,其揭示的规律在多领城发挥了重要作用。下表是元素周期表中部分短周期主族元素的有关信息:
元素编号 | 元素性质或原子结构 |
T | 核外有 5 种不同能量的电子,且最外层有 2 对成对电子 |
X | 最高化合价为+7 价 |
Y | 短周期主族元素原子中半径最大 |
Z | 最高价氧化物对应水化物具有两性 |
(1)上述四种元素中,其简单离子的半径最小的是________(填离子符号)。
(2)T 和 X 对应的元素,其气态氢化物稳定性较强的是_______(填化学式)。
(3)用原子结构的知识,说明 T 和 X 对应元素的非金属性的相对强弱。在 T 对应元素的气态氢化物,其水溶液中滴加 X 单质的水溶液,现象是_______,写出反应的离子方程式 _______。
(4)Y 和 Z 对应元素,其最高价氧化物对应水化物可发生反应。写出该反应的离子方程式________。
(5)可用 Z 对应元素的单质,与氧化铁反应来冶炼铁。若反应中生成了11.2g单质,则转移电子的数目为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
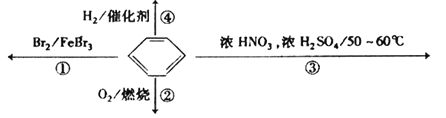
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目: 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
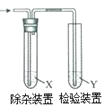
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目: 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水的图像如图所示,下列说法正确的是( )

A.a点时c(Cl-)=2c(NH3H2O)+2c(NH![]() )
)
B.b点表示酸碱恰好完全反应
C.c点时c(NH![]() )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.a、b、c、d均有c(NH![]() )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A. 78g苯中含有的碳碳双键的数目为3NA
B. 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C. 将1mol H2与 1 mol I2充入一密闭容器中充分反应后,转移的电子书为2NA
D. 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com