
科目: 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出下列四种元素的元素名称:
A:___,B:____,C:____,D:____。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。C:___,D:___。
(3)写出A、B两种元素单质在一定条件下反应的化学方程式:____。
(4)写出B2A4的电子式:____。
(5)写出C3B2化合物与水反应的方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是s能级与p能级的原子轨道图:
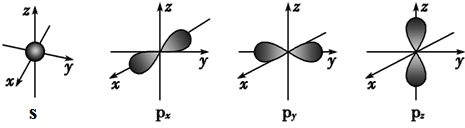
请回答下列问题:
(1)s电子的原子轨道呈_____形,每个s能级有_____个原子轨道;
(2)p电子的原子轨道呈_____形,每个p能级有_____个原子轨道.
(3)Na、Mg、Al第一电离能的由大到小的顺序:__________________。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:①2s ②3d ③4s ④3s ⑤4p ⑥3p轨道能量由低到高排列顺序是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中.正确的是( )

A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目: 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是( )
A.BF3与PCl3为三角锥形B.SO3与CO32-为平面三角形
C.SO2键角大于120oD.BF3是三角锥形分子
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
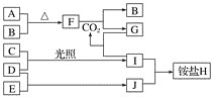
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学一一选修3:物质结构与性质】过渡金属元素的单质及化合物在科学研究和工业生产中具有许多用途,根据所学知识回答下列问题:
(1)基态Ni2+的核外电子排布式_______________;配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,固态Ni(CO)4,属于_______________晶体;镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的价电子排布为3d10,则其杂化轨道类型为_______________,Ni(CO)4是_______________(填“极性”或“非极性” )分子。
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为_______________;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含_______________个配位键。

(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为__________; 类卤素 (SCN)2 对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是_______________。
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为_______________g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。

人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸纳(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价
是_________,该反应中氧化剂和还原剂的物质的量之比为_____________。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色MnO2沉淀生成。
①ClO2和MnO2均属于氧化物,理由是___________________。
②该反应的离子方程式为_____________________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mg L-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,其关系如下图所示:

①实验中使用的C1O2溶液的物质的量浓度为____________(保留三位有效数字);要使NO的去除率更高,应控制的条件是__________________________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaC1O2,写出碱性条件下NaClO2脱除NO反应的离子方程式:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如下图所示:
![]()
Na2S2O3在此过程中表现________性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为_________价,反应的离子方程式为______________________。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
(_____)CrO3 +(_____)CH3CH2OH +(_____)H2SO4 —(_____)CH3CHO + (_____)Cr2(SO4)3+(_____)H2O
(3)已知存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13;
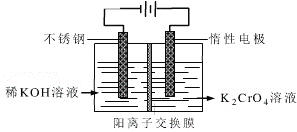
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为____________________。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com