
科目: 来源: 题型:
【题目】下列说法正确的是
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.1-二环丙基乙烯(![]() )的二氯代物共有(不含立体异构)9种
)的二氯代物共有(不含立体异构)9种
查看答案和解析>>
科目: 来源: 题型:
【题目】从硅的氧化物可以制取硅单质,主要化学反应如下:粗硅的制取:
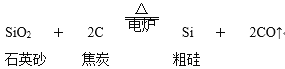
由粗硅制纯硅(常用方法):Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
根据以上反应,回答下列问题。
(1)在制取粗硅的反应中,焦炭的作用是什么___?
(2)在由粗硅制纯硅的反应中,氯气(Cl2)与Si的反应属于什么类型的反应___?SiCl4与H2的反应属于什么类型的反应___?H2的作用是什么___?
(3)在半导体工业中有这样一句行话:“从沙滩到用户”,你是如何理解的___?
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某有机物A的红外光谱和1H核磁共振谱如下图所示,下列说法中错误的是( )
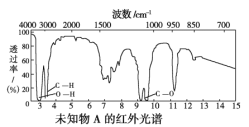
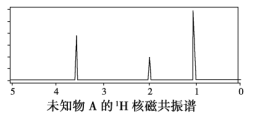
A. 由红外光谱图可知,该有机物中至少含有三种不同的化学键
B. 由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
D. 仅由其1H核磁共振谱就可得知其分子中的氢原子总数
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
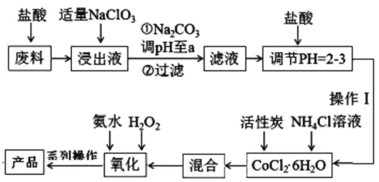
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,满足下图物质一步转化关系的选项是
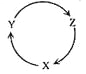
选项 | X | Y | Z |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu(OH)2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为___,I的元素名称为___。
(2)写出基态时K元素原子的电子排布式___,J元素原子的外围电子排布式___。
(3)下列对比正确的是___。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是___。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
查看答案和解析>>
科目: 来源: 题型:
【题目】铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
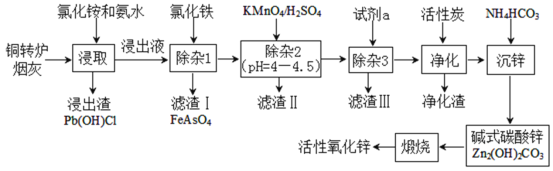
己知:活性炭净化主要是除去有机杂质。
(1)写出氯化铵的电子式___,“净化”过程属于___(填“物理”、“化学”)变化。
(2)在反应温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为___mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
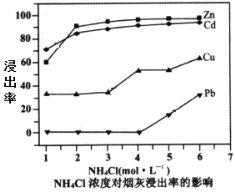
(3)滴加KMnO4溶液有MnO2生成,目的是除___元素,除杂3是置换除杂过程,则试剂a是___,“滤渣Ⅲ”的主要成分为___(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式___,此过程中可以循环利用的副产品是___。
(5)取mg活性氧化锌样品配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分前36号元素的性质或原子结构如下表
元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
【答案】 氮原子2p轨道半充满,能量低,稳定 否 F的电负性最大,只能得电子 2s22p5 2 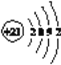 能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】试题分析:R元素的基态原子最外层有3个未成对电子,次外层有2个电子,R是N元素;S元素的单质能与水剧烈反应,所得溶液呈弱酸性,S是F元素;T元素的基态原子3d轨道上有1个电子,T是21号元素Sc; X元素的原子核外有12个电子,X是Mg元素。
解析:根据以上分析,(1)R是N元素,氮原子2p轨道半充满,能量低,稳定,所以第一电离能要大于其同周期相邻的O元素。
(2)元素F的电负性最大,只能得电子,所以F元素没有正价;F元素的最外层电子排布式为2s22p5。
(3)Sc原子的核外电子排布式是1s22s22p63s23p63d14s2,所以N能层上电子数为2,其原子结构示意图为 。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
【题型】综合题
【结束】
20
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯基环丁烯酮(![]() PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
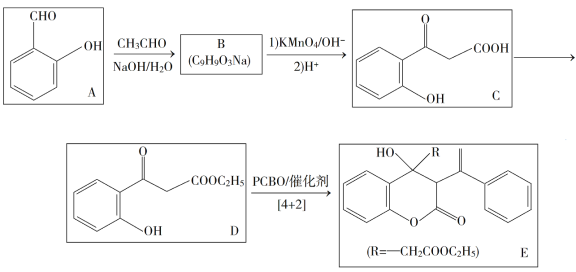
已知如下信息:

回答下列问题:
(1)A的化学名称是___________。
(2)B的结构简式为___________。
(3)由C生成D所用的试别和反应条件为___________;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,该副产物的结构简式为________。
(4)写出化合物E中含氧官能团的名称__________;E中手性碳(注:连有四个不同的原子或基团的碳)的个数为___________。
(5)M为C的一种同分异构体。已知:1 mol M与饱和碳酸氢钠溶液充分反应能放出2 mol二氧化碳;M与酸性高锰酸钾溶液反应生成对苯二甲酸。M的结构简式为__________。
(6)对于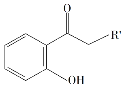 ,选用不同的取代基R',在催化剂作用下与PCBO发生的[4+2]反应进行深入研究,R'对产率的影响见下表:
,选用不同的取代基R',在催化剂作用下与PCBO发生的[4+2]反应进行深入研究,R'对产率的影响见下表:
R' | —CH3 | —C2H5 | —CH2CH2C6H5 |
产率/% | 91 | 80 | 63 |
请找出规律,并解释原因___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com