
【题目】已知某有机物A的红外光谱和1H核磁共振谱如下图所示,下列说法中错误的是( )
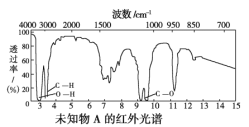
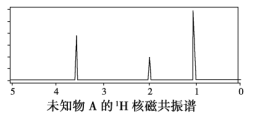
A. 由红外光谱图可知,该有机物中至少含有三种不同的化学键
B. 由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
D. 仅由其1H核磁共振谱就可得知其分子中的氢原子总数
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1, I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1, I4=10 540 kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式_________。
(2)比较BA2-和BA3的键角∠ABA的大小:BA2-____(填“>”“=”或“<”)BA3,请用价层电子对互斥理论解释:____________。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() 该同学所画的电子排布图违背了_______。
该同学所画的电子排布图违背了_______。
(4)E位于_____族_____区,价电子排布式为______。
(5)检验D元素的方法是______,请用原子结构的知识解释产生此现象的原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
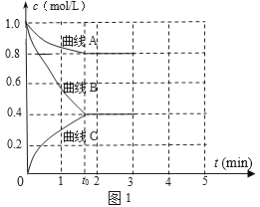
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
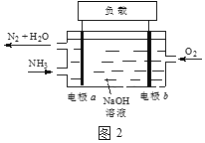
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定
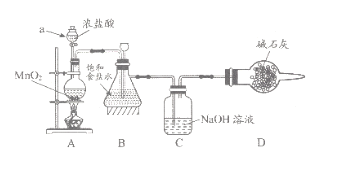
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为11;
2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_____,装置A中发生反应的离子方程式________。
②实验1中B瓶溶液中产生现象的原因是_________。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______。
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤Ⅰ的C瓶中发生反应的离子方程式为_______。
②步骤Ⅱ通常选用___作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_____g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH2Cl2
⑥CH2Cl2
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的名称__________,B的键线式 _________,C的结构简式 _____________。
(2)在①~⑥的各步反应中,属于取代反应的有_________,属于加成反应的有________。
(3)反应③的化学方程式是_____________________________________________________
(4)反应④的化学方程式是_____________________________________________________
(5)反应⑥的化学方程式是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
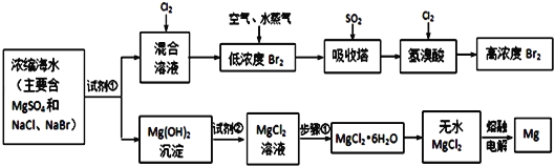
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________。
(2)吸收塔中反应的离子方程式是_______,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/L AgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com