
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
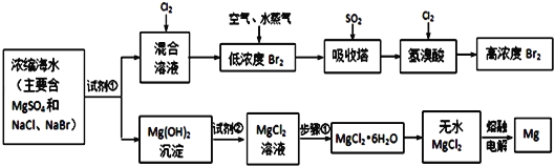
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________。
(2)吸收塔中反应的离子方程式是_______,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/L AgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
【答案】2Br-+Cl2=2Cl-+Br2 SO2+2H2O+Br 2=4H++2 Br-+SO42- 2mol 6.4 Ca(OH)2 过滤 MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
浓缩海水中主要含MgSO4、NaCl、NaBr,加入试剂氢氧化钙或氢氧化钠沉淀镁离子,过滤得到混合溶液中通入氯气,得到低浓度的溴单质,进入吸收塔用二氧化硫吸收得到溴化氢,再通入氯气得到高浓度的溴单质,氢氧化镁沉淀中加入盐酸溶液溶解得到氯化镁溶液,加热、蒸发、冷却、结晶、过滤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到氯化镁固体,电解熔融氯化镁得到镁和氯气。
由上述分析可知:
I.(1)浓缩海水与试剂①反应得到氢氧化镁,剩余混合液中含有的是溴离子,通入氯气后,氯气与溴离子反应生成单质溴和氯离子,其离子方程式是Cl2+2Br-═2 Cl-+Br2;答案为:Cl2+2Br-═2 Cl-+Br2。
(2)单质溴经过空气吹出法后被富集在吸收塔,通入的二氧化硫与单质溴反应生成硫酸和氢溴酸,其化学方程式是:Br2+SO2+2H2O═2H2SO4+2HBr,即其离子方程式为Br2+SO2+2H2O═4H++SO42-+2 Br-;由①Cl2+2Br-═2 Cl-+Br2,②Br2+SO2+2H2O═4H++SO42-+2 Br-,③Cl2+2Br-═2 Cl-+Br2,可知工业生产1mol Br2,需要2molCl2;答案为Br2+SO2+2H2O═4H++SO42-+2 Br-,2mol。
(3)由反应Ag++Cl-=AgCl↓,Cl2+2Br-═2 Cl-+Br2,可知n(Ag+)~n(Cl-)~n(Br-),由银元素的物质的量为0.1mol/L×8×10-3L=0.8×10-3mol,则溴元素的物质的量也为0.8×10-3mol,溴元素的质量为0.8×10-3mol×80g/mol=64×10-3g=64mg,则海水中含溴的含量为![]() =6.4mg/L;答案为6.4mg/L。
=6.4mg/L;答案为6.4mg/L。
II.(1)为了使MgSO4转化为Mg(OH)2,从经济理念出发,试剂①可以选用由海洋中的贝壳得到的固体Ca(OH)2使MgSO4完全转化为沉淀;答案为Ca(OH)2。
(2)要从氯化镁溶液得到含结晶水的氯化镁,就需要蒸发、冷却、结晶,并通过过滤把固体从溶液中分离出来;答案为过滤。
(3)氯化镁电解为分解反应,产物为镁和氯气,所以电解方程式为:MgCl2(熔融)![]() Mg+Cl2↑;答案为MgCl2(熔融)
Mg+Cl2↑;答案为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。


科目:高中化学 来源: 题型:
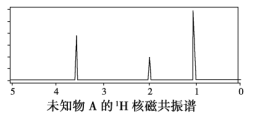
【题目】已知某有机物A的红外光谱和1H核磁共振谱如下图所示,下列说法中错误的是( )
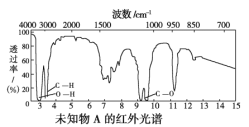
A. 由红外光谱图可知,该有机物中至少含有三种不同的化学键
B. 由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
D. 仅由其1H核磁共振谱就可得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关键环节题组:有机合成路线设计
(1)用丙醛(CH3—CH2—CHO)制取聚丙烯的过程中发生的反应类型为________
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原
A.⑥②③ B.⑤②③ C.②④⑤ D.①④⑥
(2)以CH2==CHCH2OH为主要原料(无机试剂任用)设计CH2==CHCOOH的合成路线流程图(已知CH2=CH2可被氧气催化氧化为 ![]() )_________________
)_________________
学法题:通过此题的解答,总结设计有机合成路线需注意(至少写2条)___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是
A. CO2是氧化产物
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于ClO2的氧化性
D. 1mol KClO3参加反应,转移的电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组进行Cu和Fe2(SO4)3溶液的实验。实验探究过程如下:
实验装置:
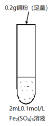
实验操作与现象: ⅰ.加入Cu粉后充分振荡,静置,溶液变成浅蓝绿色;
ⅱ.取少量ⅰ中清液于试管中,滴加3滴0.1mol/L KSCN溶液,立即出现白色沉淀,溶液局部变为红色,振荡后红色迅速褪去。
查阅资料:
Ⅰ.Cu2+可与SCN-反应生成CuSCN(白色沉淀)和(SCN)2: (SCN)2的性质与Cl2相似。
Ⅱ.CuSCN能与稀硝酸反应:CuSCN+HNO3→CuSO4+N2↑+CO2+H2O(未配平)。
回答下列问题:
(1)Cu和Fe2(SO4)3溶液反应的离子方程式为________。
(2)根据表中实验现象推断白色沉淀为___________。为验证该白色沉淀,取少量白色沉淀于试管中,加入___,若____即可证明(补充所加试剂及实验现象)。
(3)试解释ⅱ中溶液局部变为红色的原因是______。
(4)根据ⅱ中实验现象可推知SCN-更易与_______结合(填“Fe3+”或“Cu+”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 制备乙酸乙酯 | 比较Cl2、I2的氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的![]() 、
、![]() 混合溶液中滴加稀盐酸。
混合溶液中滴加稀盐酸。
①在滴加盐酸过程中,溶液中![]() 与含硫各物质浓度的大小关系为______(选填字母)。
与含硫各物质浓度的大小关系为______(选填字母)。
a. ![]()
b. ![]()
c. ![]()
d. ![]()
②![]() 溶液中所有阴离子浓度由大到小排列是____________;
溶液中所有阴离子浓度由大到小排列是____________;![]() 溶液呈碱性,若向溶液中加入
溶液呈碱性,若向溶液中加入![]() 溶液,恰好完全反应,所得溶液呈强酸性,其原因是____________(用离子方程式表示)。
溶液,恰好完全反应,所得溶液呈强酸性,其原因是____________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )

CaTiO3晶体的结构模型
A. 分子晶体中都存在共价键
B. 金属晶体的熔点都比分子晶体的熔点高
C. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
D. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com