
【题目】关键环节题组:有机合成路线设计
(1)用丙醛(CH3—CH2—CHO)制取聚丙烯的过程中发生的反应类型为________
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原
A.⑥②③ B.⑤②③ C.②④⑤ D.①④⑥
(2)以CH2==CHCH2OH为主要原料(无机试剂任用)设计CH2==CHCOOH的合成路线流程图(已知CH2=CH2可被氧气催化氧化为 ![]() )_________________
)_________________
学法题:通过此题的解答,总结设计有机合成路线需注意(至少写2条)___________________________
【答案】A CH2=CHCH2OH![]() CH2CHClCH2OH
CH2CHClCH2OH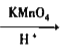 CH2CHClCOOH
CH2CHClCOOH![]() CH2=CHCOONa
CH2=CHCOONa![]() CH2=CHCOOH 选择合适的反应条件、要注意官能团的保护
CH2=CHCOOH 选择合适的反应条件、要注意官能团的保护
【解析】
(1)可用逆推法![]() →CH2=CH-CH3→CH2OH-CH2-CH3→CH3-CH2-CHO,以此判断可能发生的反应;
→CH2=CH-CH3→CH2OH-CH2-CH3→CH3-CH2-CHO,以此判断可能发生的反应;
(2)以CH2=CHCH2OH为主要原料合成CH2=CHCOOH, CH2=CHCH2OH可先和HCl发生加成反应,保护碳碳双键,再利用强氧化剂将醇羟基氧化为羧基,最后再结合卤代烃的消去引入碳碳双键即可;合成时要注意反应条件和官能团的保护。
(1)要制取![]() ,可逆推反应流程:
,可逆推反应流程:![]() →CH2=CH-CH3→CH2OH-CH2-CH3→CH3-CH2-CHO,则从后往前推断可发生加成(还原)、消去、加聚反应,故答案为A;
→CH2=CH-CH3→CH2OH-CH2-CH3→CH3-CH2-CHO,则从后往前推断可发生加成(还原)、消去、加聚反应,故答案为A;
(2)以CH2=CHCH2OH为主要原料合成CH2=CHCOOH, CH2=CHCH2OH可先和HCl发生加成反应,保护碳碳双键,再利用强氧化剂将醇羟基氧化为羧基,最后再结合卤代烃的消去引入碳碳双键,具体合成路线为:CH2=CHCH2OH![]() CH2CHClCH2OH
CH2CHClCH2OH CH2CHClCOOH
CH2CHClCOOH![]() CH2=CHCOONa
CH2=CHCOONa![]() CH2=CHCOOH;在选择合成路线时,需要选择合适的反应条件,同时注意官能团的保护,上述流程中用强氧化剂氧化羟基生成羧基时需要防碳碳双键被氧化,故需要先保护碳碳双键。
CH2=CHCOOH;在选择合成路线时,需要选择合适的反应条件,同时注意官能团的保护,上述流程中用强氧化剂氧化羟基生成羧基时需要防碳碳双键被氧化,故需要先保护碳碳双键。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1, I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1, I4=10 540 kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式_________。
(2)比较BA2-和BA3的键角∠ABA的大小:BA2-____(填“>”“=”或“<”)BA3,请用价层电子对互斥理论解释:____________。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() 该同学所画的电子排布图违背了_______。
该同学所画的电子排布图违背了_______。
(4)E位于_____族_____区,价电子排布式为______。
(5)检验D元素的方法是______,请用原子结构的知识解释产生此现象的原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的名称__________,B的键线式 _________,C的结构简式 _____________。
(2)在①~⑥的各步反应中,属于取代反应的有_________,属于加成反应的有________。
(3)反应③的化学方程式是_____________________________________________________
(4)反应④的化学方程式是_____________________________________________________
(5)反应⑥的化学方程式是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是
A.单质的氧化性:X>M
B.气态氢化物的热稳定性:M>N
C.X与Y简单离子半径:r(X离子)<r(Y离子)
D.化合物ZX2与ZN4含有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素(Cr)的化合物存在下列转化关系:

下列判断错误的是
A.反应①表明Cr2O3,具有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应③发生的反应为2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
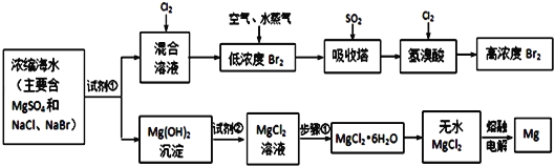
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________。
(2)吸收塔中反应的离子方程式是_______,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/L AgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
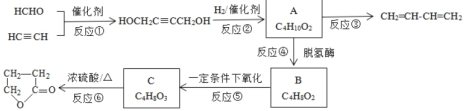
【题目】如图是物质A的一种制备方法以及由A引发的系列反应。
完成下列填空:
(1)HCHO中官能团的名称___。
(2)写出实验室制备CH![]() CH的化学方程式:__。
CH的化学方程式:__。
(3)写出反应类型。反应①:___反应,反应③:___反应。
(4)化合物B含酯基的同分异构体共4种,写出其余3种的结构简式:___。
(5)如何检验B是否完全转化为C?__。
(6)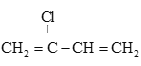 是制备氯丁橡胶的原料,以下是一种以CH2=CH-CH=CH2为原料制备
是制备氯丁橡胶的原料,以下是一种以CH2=CH-CH=CH2为原料制备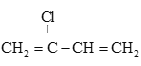 的合成路线的一部分,请补全其余3步:CH2=CH-CH=CH2
的合成路线的一部分,请补全其余3步:CH2=CH-CH=CH2 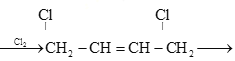 ________,(合成路线常用的表示方式为:甲
________,(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com