
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是
A. CO2是氧化产物
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于ClO2的氧化性
D. 1mol KClO3参加反应,转移的电子为1mol
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
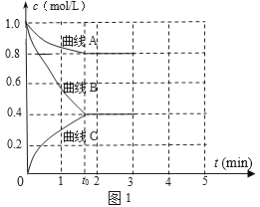
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
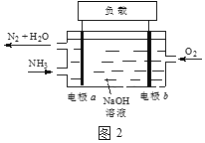
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素(Cr)的化合物存在下列转化关系:

下列判断错误的是
A.反应①表明Cr2O3,具有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应③发生的反应为2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
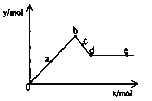
A. a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B. c—d时溶液中离子的物质的量:AlO2–比Ba2+多
C. a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D. d—e时溶液中离子的物质的量:Ba2+不能等于OH–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
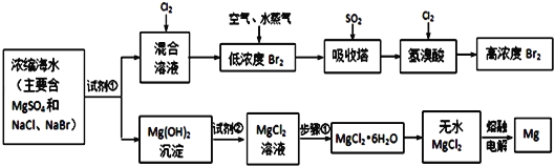
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________。
(2)吸收塔中反应的离子方程式是_______,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/L AgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)2AB(l)的能量变化如图所示,判断下列叙述中正确的是
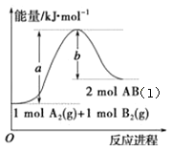
A.每生成2mol气态AB吸收b kJ热量
B.向密闭容器中充入1mol A2和1mol B2充分反应,吸收的热量为(a-b)kJ
C.向密闭容器中充入一定量的A2和B2,生成2mol AB(g),吸收的热量小于(a-b)kJ
D.AB(l)分解为A2(g)和B2(g)的反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com