
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定
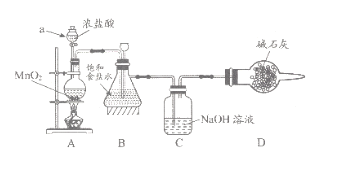
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为11;
2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_____,装置A中发生反应的离子方程式________。
②实验1中B瓶溶液中产生现象的原因是_________。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______。
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤Ⅰ的C瓶中发生反应的离子方程式为_______。
②步骤Ⅱ通常选用___作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_____g/L(保留2位小数)
【答案】分液漏斗 MnO2 +4H+ +2Cl-![]() Mn2++Cl2↑+2H2O B瓶的饱和食盐水中吸收了A装置挥发出的HCl气体而呈酸性 C瓶溶液中存在平衡Cl2+H2O
Mn2++Cl2↑+2H2O B瓶的饱和食盐水中吸收了A装置挥发出的HCl气体而呈酸性 C瓶溶液中存在平衡Cl2+H2O![]() HCl+HClO,HCO3-消耗H+,使平衡右移,HClO的浓度增大,HClO具有漂白性,使紫色石蕊立即褪色 ClO-+2I-+2H+=I2+Cl-+H2O 淀粉溶液 当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色 4.47
HCl+HClO,HCO3-消耗H+,使平衡右移,HClO的浓度增大,HClO具有漂白性,使紫色石蕊立即褪色 ClO-+2I-+2H+=I2+Cl-+H2O 淀粉溶液 当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色 4.47
【解析】
(1)①根据装置图分析仪器a的名称;装置A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气、水;
②实验1中B瓶中饱和食盐水吸收A挥发的氯化氢;
③Cl2+H2O![]() HCl+HClO,酸性HCl> H2CO3 > HClO>HCO3-,HCO3-与HCl反应、不与HClO反应;
HCl+HClO,酸性HCl> H2CO3 > HClO>HCO3-,HCO3-与HCl反应、不与HClO反应;
(2)①C瓶中酸性条件下ClO-把I-氧化为I2;
②碘单质能使淀粉变蓝;滴入Na2S2O3消耗I2;
③根据关系式NaClO~I2~2S2O32-计算C瓶溶液中NaClO含量。
(1)①根据装置图,仪器a的名称是分液漏斗;装置A中二氧化锰与浓盐酸加热条件下反应生成氯化锰、氯气、水,反应离子方程式是MnO2 +4H+ +2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②实验1中B瓶的饱和食盐水中吸收了A装置挥发出的HCl气体而呈酸性,滴加紫色石蕊试液;溶液变红;
③C瓶溶液中存在平衡Cl2+H2O![]() HCl+HClO, HCO3-与HCl反应、不与HClO反应,HCO3-消耗HCl,使平衡右移,HClO的浓度增大,HClO具有漂白性,使紫色石蕊立即褪色;
HCl+HClO, HCO3-与HCl反应、不与HClO反应,HCO3-消耗HCl,使平衡右移,HClO的浓度增大,HClO具有漂白性,使紫色石蕊立即褪色;
(2)①C瓶中酸性条件下ClO-把I-氧化为I2,反应离子方程式是ClO-+2I-+2H+=I2+Cl-+H2O;
②碘单质能使淀粉变蓝,步骤Ⅱ通常选用淀粉溶液作指示剂;滴入Na2S2O3消耗I2,滴定终点的现象是当加入最后一滴Na2S2O3溶液,溶液由蓝色变为无色,且半分钟不变色;
③设NaClO的质量为xg;
NaClO~I2~2S2O32-
74.5g 2mol
Xg 0.1000mol/L×0.024L
![]()
X=0.0894g,C瓶溶液中NaClO含量为![]() g/L。
g/L。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】I.某化学实验小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,某同学设计了如图所示的实验装置(氯气易溶于CCl4,HCl不溶于CCl4)。
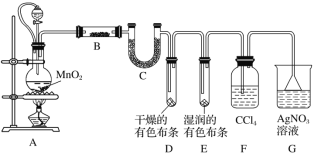
请回答下列问题:
(1)装置A中连接橡皮管的目的是_____________________________________。
(2)装置A中发生反应的离子方程式为_________________________________,装置B中盛放的试剂是___________。
(3)装置D与E中出现的不同现象说明的问题是_________________________。
(4)有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉KI试纸的装置,其目的是___________________________________。
Ⅱ.某研究性学习小组欲制备漂白粉,设计在上述装置A后连接如右图所示的组合装置:
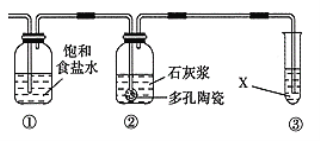
(5)装置②中发生反应的化学方程为___________________________________。
(6)制漂白粉的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某橙色含结晶水的盐X的组成和性质,设计并完成如图实验。请回答:

(1)X的化学式是___。
(2)乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是__(填写相应的字母)。
A.Mg B.CaCl2 C.NaOH D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①![]() Li ②石墨 ③C60 ④
Li ②石墨 ③C60 ④![]() Mg ⑤ CH3CH2OH ⑥
Mg ⑤ CH3CH2OH ⑥![]() C ⑦
C ⑦![]() Li ⑧ CH3OCH3 中:____互为同位素; ____互为同分异构体;___互为同素异形体(填序号)
Li ⑧ CH3OCH3 中:____互为同位素; ____互为同分异构体;___互为同素异形体(填序号)
(2)现有①CaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤冰 等五种物质,按下列要求回答:
①熔化时不需要破坏化学键的是___________,熔点最高的是_______。(填序号)
②只含有离子键的物质是______,晶体以分子间作用力结合的是______。(填序号)
(3)写出下列物质的电子式
①H2O______
②NaOH______
③NH3______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中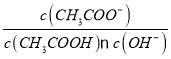 不变
不变
B.溶液中导电粒子的数目减少
C.醋酸的电离程度增大,c(H+)亦增大
D.完全致中和醋酸需加入10mLpH=11的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和1H核磁共振谱如下图所示,下列说法中错误的是( )
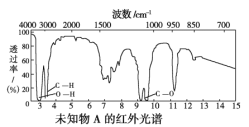
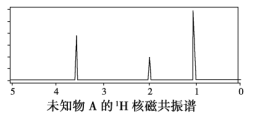
A. 由红外光谱图可知,该有机物中至少含有三种不同的化学键
B. 由1H核磁共振谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
D. 仅由其1H核磁共振谱就可得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)甲基的电子式__________;
(2)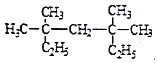 系统命名法为_________________;
系统命名法为_________________;
(3)键线式![]() 表示的有机物的结构简式是____________;
表示的有机物的结构简式是____________;
(4)烷烃A在同温同压下蒸气的密度是H2的36倍,烷烃A的结构简式为________________.
(5)相对分子质量为70的烯烃的分子式为_________,若该烯烃与足量H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为_________。
(6)写出下列反应的化学方程式:
①实验室制取乙炔_____________________________________________________。
②2 -氯丙烷的消去反应_____________________________________________________。
③用甲苯制TNT的反应_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量____1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值____110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;
(6)可逆反应:aA(气)+bB(气)![]() cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:

P1______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组进行Cu和Fe2(SO4)3溶液的实验。实验探究过程如下:
实验装置:
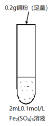
实验操作与现象: ⅰ.加入Cu粉后充分振荡,静置,溶液变成浅蓝绿色;
ⅱ.取少量ⅰ中清液于试管中,滴加3滴0.1mol/L KSCN溶液,立即出现白色沉淀,溶液局部变为红色,振荡后红色迅速褪去。
查阅资料:
Ⅰ.Cu2+可与SCN-反应生成CuSCN(白色沉淀)和(SCN)2: (SCN)2的性质与Cl2相似。
Ⅱ.CuSCN能与稀硝酸反应:CuSCN+HNO3→CuSO4+N2↑+CO2+H2O(未配平)。
回答下列问题:
(1)Cu和Fe2(SO4)3溶液反应的离子方程式为________。
(2)根据表中实验现象推断白色沉淀为___________。为验证该白色沉淀,取少量白色沉淀于试管中,加入___,若____即可证明(补充所加试剂及实验现象)。
(3)试解释ⅱ中溶液局部变为红色的原因是______。
(4)根据ⅱ中实验现象可推知SCN-更易与_______结合(填“Fe3+”或“Cu+”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com