
����Ŀ���밴����Ҫ����գ�
(1)���ĵ���ʽ__________��
(2)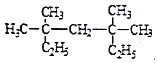 ϵͳ������Ϊ_________________��
ϵͳ������Ϊ_________________��
(3)����ʽ![]() ��ʾ���л���Ľṹ��ʽ��____________��
��ʾ���л���Ľṹ��ʽ��____________��
(4)����A��ͬ��ͬѹ���������ܶ���H2��36��������A�Ľṹ��ʽΪ________________��
(5)��Է�������Ϊ70��ϩ���ķ���ʽΪ_________������ϩ��������H2�ӳɺ������ɺ�3���������������ϩ�����ܵĽṹ��ʽΪ_________��
(6)д�����з�Ӧ�Ļ�ѧ����ʽ��
��ʵ������ȡ��Ȳ_____________________________________________________��
��2 -�ȱ������ȥ��Ӧ_____________________________________________________��
���üױ���TNT�ķ�Ӧ_____________________________________________________��
���𰸡�![]() 3��3��5��5-�ļ�����
3��3��5��5-�ļ����� ![]() CH3CH2CH2CH2CH3��
CH3CH2CH2CH2CH3��![]() ��
��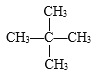 C5H10
C5H10 ![]() ��
��![]() ����CH3��2CHCH=CH2 CaC2+2H2O��Ca(OH)2+C2H2�� CH3CHClCH3+NaOH
����CH3��2CHCH=CH2 CaC2+2H2O��Ca(OH)2+C2H2�� CH3CHClCH3+NaOH![]() CH2=CH-CH3+NaCl+H2O
CH2=CH-CH3+NaCl+H2O ![]() +3HNO3
+3HNO3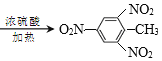 +3H2O
+3H2O
��������
(1)Cԭ�Ӽ۵���Ϊ4��Cԭ�ӵ�3��������3��Hԭ���γ�3�Թ��õ��Ӷԣ�
(2)����������ϵͳ������������
(3)���ݽṹ��ʽ�ͼ���ʽ����дԭ����д��
(4)�ȸ�������ܶȼ�����������Է���������Ȼ����������ķ���ʽͨʽ��������к��е�C��Hԭ����Ŀ���õ�����ʽ��
(5)����ϩ���ķ���ʽͨʽ��CnH2n�������Է����������������C��Hԭ�Ӹ������õ���ϩ���ķ���ʽ��Ȼ���ϸ�ϩ��������H2�ӳɺ����������Ľṹ�ص㣬�õ���ϩ�����ܵĽṹ��ʽ��
(6)�ٵ�ʯ��ˮ��Ӧ������Ȳ���������ƣ�
��2 -�ȱ�����NaOH���Ҵ���Һ�ڼ���ʱ����ȥ��Ӧ��
�ۼױ���Ũ�����ڼ���ʱ����ȡ����Ӧ����TNT��ˮ��
(1)Cԭ�Ӽ۵���Ϊ4��Cԭ�ӵ�3��������3��Hԭ���γ�3�Թ��õ��Ӷԣ���˼��ĵ���ʽΪ��![]() ��
��
(2)ѡ��Cԭ��������̼��Ϊ����������֧���Ͻ���һ�˸������ϵ�Cԭ�ӱ�ţ���ȷ��֧����λ�ã���֧����ȡ�������û����������Ϊ3��3��5��5-�ļ����飻
(3)�û����������Ϊ2-�һ�-1��3-����ϩ����ṹ��ʽ��![]() ��
��
(4)����A��ͬ��ͬѹ���������ܶ���H2��36���������������Է���������M=2��36=72�����������ķ���ͨʽΪCnH2n+2��14n+2=72�����n=5��������A�Ľṹ��ʽΪC5H12�����ܵĽṹ��ʽΪCH3CH2CH2CH2CH3��![]() ��
�� ��
��
(5)ϩ���ķ���ͨʽΪCnH2n����������Է�������Ϊ70����14n=70�����n=5���ʸ�ϩ���ķ���ʽΪC5H10������ϩ��������H2�ӳɺ������ɺ�3������������˵����ϩ���ӳɲ���Ϊ��CH3��2CHCH2CH3�����ϩ�����ܵĽṹ��ʽΪ![]() ��
��![]() ����CH3��2CHCH=CH2��
����CH3��2CHCH=CH2��
(6)�ٵ�ʯ��ˮ��Ӧ������Ȳ���������ƣ���Ӧ�Ļ�ѧ����ʽΪCaC2+2H2O��Ca(OH)2+C2H2����
��2 -�ȱ�����NaOH���Ҵ���Һ�ڼ���ʱ����ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪCH3CHClCH3+NaOH![]() CH2=CH-CH3+NaCl+H2O��
CH2=CH-CH3+NaCl+H2O��
�ۼױ���Ũ�����ڼ���ʱ����ȡ����Ӧ����TNT��ˮ����Ӧ�Ļ�ѧ����ʽΪ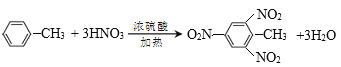 ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ա�
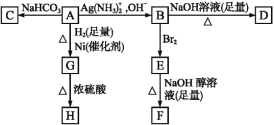
��֪H�ǻ�״������C4H6O2,F��̼ԭ�Ӷ���һ��ֱ���ϡ�
��1��������A���еĹ������� ��
��2��B��������������Br2��Ӧ�õ�E,E���������������ƴ���Һ������ת���F,��Eת���Fʱ�������ַ�Ӧ,�䷴Ӧ���ͷֱ��� ��
��3��D�Ľṹ��ʽ�� ��
��4��1 mol A��2 mol H2��Ӧ����1 mol G,�䷴Ӧ����ʽ�� ��
��5����A������ͬ�����ŵ�A��ͬ���칹��Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������µ��ܱ������У�4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H=-905.9kJ��mol-1������������ȷ����
4NO(g)+6H2O(g) ��H=-905.9kJ��mol-1������������ȷ����
A.4molNH3��5molO2��Ӧ���ﵽƽ��ʱ�ų�����Ϊ905.9kJ
B.ƽ��ʱ��5v��(O2)=4v��(NO)
C.ƽ���ѹǿ���������ƽ��Ħ����������
D.ƽ��������¶ȣ����������NO��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ����1984�걱��ijҽԺ����ʹ�ö����������ճ�������ʹ�ù㷺������Ч�ɷ���NaClO��ij��ѧ�о���ѧϰС����ʵ�����Ʊ�NaClO��Һ������������̽���ͳɷֲⶨ
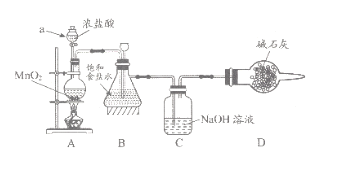
��1����ѧϰС�鰴��ͼװ�ý���ʵ��(���ּг�װ��ʡȥ)����Ӧһ��ʱ��ֱ�ȡB��Cƿ�е���Һ����ʵ�飬ʵ���������±���
��֪��1������NaClO��ҺpHΪ11��
2��25��Cʱ��������볣��Ϊ��H2CO3��K1=4.4��10��7��K2=4.7��10��11��HClO��K=3��10��8
Bƿ | Cƿ | |
ʵ��1��ȡ�����μ���ɫʯ����Һ | ��죬����ɫ | ����������ɫ |
ʵ��2���ⶨ��Һ��pH | 3 | 12 |
�ش��������⣺
������a������_____��װ��A�з�����Ӧ�����ӷ���ʽ________��
��ʵ��1��Bƿ��Һ�в��������ԭ����_________��
������Cƿ��Һ���� NaHCO3��Һ�������������������ʵ�飬Cƿ����Ϊ��ʵ��1����ɫʯ����Һ������ɫ��ʵ��2����Һ��pH=7�����ƽ���ƶ�ԭ��������ɫʯ����Һ������ɫ��ԭ��______��
��2���ⶨCƿ��Һ��NaClO����(��λ��g/L)��ʵ�鲽�����£�
��ȡCƿ��Һ20ml����ƿ�У����������ữ���������KI��Һ���ǽ�ƿ�����ڰ�����ַ�Ӧ��
����0.1000mol/LNa2S2O3����Һ�ζ���ƿ�е���Һ��ָʾ����ʾ�յ���ظ�����2~3�Σ�Na2S2O3��Һ��ƽ������Ϊ24.00ml��(��֪��I2+2S2O32��=2I��+S4O62��)
�ٲ�����Cƿ�з�����Ӧ�����ӷ���ʽΪ_______��
�ڲ����ͨ��ѡ��___��ָʾ�����ζ����յ������______��
��Cƿ��Һ��NaClO����Ϊ_____g/L(����2λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ����

A. ��Ӧ��Ϊȡ����Ӧ���л�������ˮ��ϸ����ϲ�
B. ��Ӧ��Ϊ������Ӧ����Ӧ�����ǻ�������������Ũ��
C. ��Ӧ��Ϊȡ����Ӧ���л�������һ����
D. ��Ӧ����1 mol�������3 mol H2�����ӳɷ�Ӧ����Ϊÿ�������Ӻ�������̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ�Ӧ·��������Ϣ��ա�

(1)A������__________��B�ļ���ʽ _________��C�Ľṹ��ʽ _____________��
(2)�ڢ١��ĸ�����Ӧ�У�����ȡ����Ӧ����_________�����ڼӳɷ�Ӧ����________��
(3)��Ӧ�۵Ļ�ѧ����ʽ��_____________________________________________________
(4)��Ӧ�ܵĻ�ѧ����ʽ��_____________________________________________________
(5)��Ӧ�Ļ�ѧ����ʽ��_____________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ijЩ���������˲�ͬ�̶ȵ�������������У����С���ͬѧ��������˵����о�,
��.����С���о�����,������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȡ�
(1)25��ʱ��PM2.5����������ˮ�����Ƴɴ�����Һ����ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
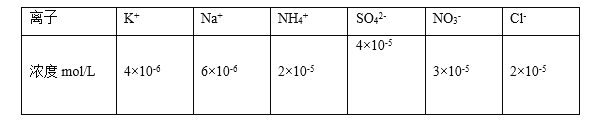
���ݱ��������ж�������pH=________��
��.���������������������һ���о�
һ�������������������о�
(1)һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ��
2NO(g)+O2(g) ![]() 2NO2(g)������״̬��˵���÷�Ӧ�ﵽ��ѧƽ�����_______������ĸ��ţ���
2NO2(g)������״̬��˵���÷�Ӧ�ﵽ��ѧƽ�����_______������ĸ��ţ���
A�����������ܶȱ��ֲ��� B��NO��ת���ʱ��ֲ���
C��NO��O2�����ʵ���֮�ȱ��ֲ��� D��O2���������ʺ�NO2�������������
(2)����̿�ɴ���������Ⱦ��NO����Ӧԭ��Ϊ��C(s)+2NO(g)![]() N2(g)+CO2(g)��T��ʱ����2L�ܱ������м���0.100mol NO��2.030mol����̿�������ʣ���ƽ��ʱ����̿���ʵ�����2.000mol������¶��µ�ƽ�ⳣ��Ϊ_________����ƽ��ʱ,�����������г���0.04molNO,0.03molN2��0.03molCO2����ƽ��________�ƶ���������������������������������
N2(g)+CO2(g)��T��ʱ����2L�ܱ������м���0.100mol NO��2.030mol����̿�������ʣ���ƽ��ʱ����̿���ʵ�����2.000mol������¶��µ�ƽ�ⳣ��Ϊ_________����ƽ��ʱ,�����������г���0.04molNO,0.03molN2��0.03molCO2����ƽ��________�ƶ���������������������������������
III.һ����̼��������̼���о�
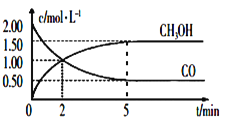
(1)CO��CO2��һ�������¿��������ϳɼ״�����ҵ�ϳ���CO��H2�Ʊ�CH3OH�ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g)�������Ϊ1L�ĺ����ܱ������У�����2molCO��4molH2��һ�������·���������Ӧ�����CO(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��5min����H2��ʾ��ƽ����Ӧ����v(H2)=_____��
CH3OH(g)�������Ϊ1L�ĺ����ܱ������У�����2molCO��4molH2��һ�������·���������Ӧ�����CO(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��5min����H2��ʾ��ƽ����Ӧ����v(H2)=_____��
(2)̼��ˮ������Ӧ��ȡH2����ط�Ӧ���£�
��C(s)+H2O(g)=CO(g)+H2(g) �� H=+131.0kJ/mol
��CO(g)+H2O(g)=CO2(g)+H2(g) �� H= - 43kJ/mol
��CaO(s)+CO2(g)=CaCO3(S) �� H= - 178.3kJ/mol
�ټ��㷴Ӧ����C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)����H=______kJ/mol��
CaCO3(s)+2H2(g)����H=______kJ/mol��
�������������о�
��SO2�ɱ�Na2FeO4������ȥ����Ⱦ����ҵ����Fe��ʯī���缫���ŨNaOH��Һ�Ʊ�Na2FeO4��д�������������������ĵ缫��Ӧ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��N��Ԫ�����ڱ��еĶ���������Ԫ�أ���ԭ���������ε�������֪X�������������Ǵ�����������3����X��Mͬ���壬Y��ͬ��������Ԫ����ԭ�Ӱ뾶���Z������ϼ�����ͻ��ϼ۵Ĵ�����Ϊ�㣮����˵����ȷ����
A.���ʵ������ԣ�X>M
B.��̬�⻯������ȶ��ԣ�M>N
C.X��Y�����Ӱ뾶��r(X����)<r(Y����)
D.������ZX2��ZN4������ͬ���͵Ļ�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10 mL 0.40 mol/L H2O2��Һ�������ֽ⣬��ͬʱ�̲������O2�����(������Ϊ��״��)���±���������Һ����仯��������������ȷ����
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A.�÷�Ӧ����MnO2��FeCl3��Һ��Ϊ����
B.0��4 min��ƽ����Ӧ����v(H2O2)��3.75��10-2mol/(L��min)
C.0��10 min����������ķֽ������ӿ�
D.��Ӧ��6 minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com