
【题目】为探究某橙色含结晶水的盐X的组成和性质,设计并完成如图实验。请回答:

(1)X的化学式是___。
(2)乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是__(填写相应的字母)。
A.Mg B.CaCl2 C.NaOH D.K2SO4
【答案】KICl2·H2O AC
【解析】
某橙色含结晶水的盐X加热分解,生成的化合物甲加入硝酸酸化的硝酸银溶液后产生1mol白色沉淀,白色沉淀为氯化银,说明1mol甲中含有1mol氯离子;X生成的化合物乙为红棕色,与KI发生氧化还原反应后生成单质丙和化合物甲,单质丙遇淀粉变蓝,说明单质丙为I2,化合物甲含有钾离子,说明化合物甲为KCl,综上所述,无其余阳离子参与反应,化合物乙为ICl。
(1)根据元素守恒定律,乙与KI反应生成KCl和I2,乙发生还原反应,即乙为ICl,且1molX分解生成1mol氯化钾,1molICl,1mol水,说明X的化学式是KICl2·H2O。
(2)A. Mg能与卤族单质发生化合反应,A正确;
B.CaCl2与卤族单质不发生反应,B错误;
C.NaOH能与卤族单质发生歧化反应,C正确;
D.K2SO4与卤族单质不发生反应,D错误;
综上所述,能与乙发生反应的是AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
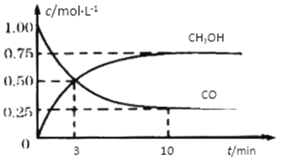
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图填空。
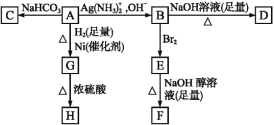
已知H是环状化合物C4H6O2,F的碳原子都在一条直线上。
(1)化合物A含有的官能团是 。
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变成F,由E转变成F时发生两种反应,其反应类型分别是 。
(3)D的结构简式是 。
(4)1 mol A与2 mol H2反应生成1 mol G,其反应方程式是 。
(5)与A具有相同官能团的A的同分异构体的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。完成下列填空:
(1)上述烟气处理过程中涉及到的化学物质组成元素中,属于第三周期元素的是___;写出N的核外电子排布式___。
(2)已知SO2分子的空间构型为折线形,则SO2为___(选填“极性”、“非极性”)分子。
(3)将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时问后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42- | NO3- | OH- | Cl- |
浓度/(mol·L-1) | 5.5×10-3 | 8.5×10-4 | y | 2.0×10-4 | 3.4×10-3 |
①反应后溶液pH___7,表中y=___mol·L-1。
②写出NaClO2溶液吸收SO2的离子方程式___。
(4)烟气中的SO2还可采用氨法脱硫除去,其反应原理可用如图表示。
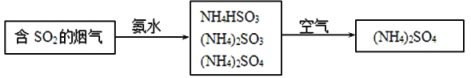
①写出SO2跟氨水反应生成NH4HSO3的化学方程式___。
②(NH4)2SO4溶液中浓度最大的离子是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的研究与应用越来越受到人们的重视。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,可由TiCl4和LiBH4反应制得。
①在基态Ti2+中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为____
②LiBH4由Li+和BH4-构成,BH4-的立体结构是____,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为_____。
③TiCl4在常温下是无色液体,则TiCl4属于_______(填“原子”“分子”或“离子”)晶体。
(2)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮(![]() )分子中含有π键与σ键数目之比为______。
)分子中含有π键与σ键数目之比为______。
②甲醛(![]() )分子中C原子轨道杂化类型为_______;
)分子中C原子轨道杂化类型为_______;
甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b._______。
(3)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有__个,Ti原子的配位数为______;该晶胞中N、Ti原子之间的最近距离为a nm,则该氮化钛晶体的密度为_______g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
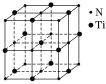
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1, I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1, I4=10 540 kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式_________。
(2)比较BA2-和BA3的键角∠ABA的大小:BA2-____(填“>”“=”或“<”)BA3,请用价层电子对互斥理论解释:____________。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() 该同学所画的电子排布图违背了_______。
该同学所画的电子排布图违背了_______。
(4)E位于_____族_____区,价电子排布式为______。
(5)检验D元素的方法是______,请用原子结构的知识解释产生此现象的原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定
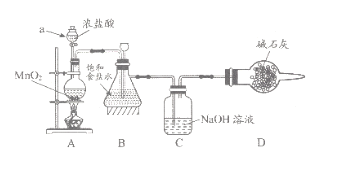
(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为11;
2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_____,装置A中发生反应的离子方程式________。
②实验1中B瓶溶液中产生现象的原因是_________。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______。
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤Ⅰ的C瓶中发生反应的离子方程式为_______。
②步骤Ⅱ通常选用___作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_____g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零.下列说法正确的是
A.单质的氧化性:X>M
B.气态氢化物的热稳定性:M>N
C.X与Y简单离子半径:r(X离子)<r(Y离子)
D.化合物ZX2与ZN4含有相同类型的化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com