
【题目】钛及其化合物的研究与应用越来越受到人们的重视。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,可由TiCl4和LiBH4反应制得。
①在基态Ti2+中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为____
②LiBH4由Li+和BH4-构成,BH4-的立体结构是____,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为_____。
③TiCl4在常温下是无色液体,则TiCl4属于_______(填“原子”“分子”或“离子”)晶体。
(2)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮(![]() )分子中含有π键与σ键数目之比为______。
)分子中含有π键与σ键数目之比为______。
②甲醛(![]() )分子中C原子轨道杂化类型为_______;
)分子中C原子轨道杂化类型为_______;
甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b._______。
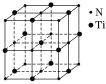
(3)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有__个,Ti原子的配位数为______;该晶胞中N、Ti原子之间的最近距离为a nm,则该氮化钛晶体的密度为_______g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
【答案】M 9 正四面体形 H>B>Li 分子 1∶9 sp2杂化 甲醛与水分子之间能形成氢键 12 6 ![]()
【解析】
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d2;
②BH4-中B原子的价层电子对数为4,孤电子对数为0;非金属性越强,电负性越大,金属性越强,电负性越小;
(2)①丙酮分子中含有碳氧双键,1个丙酮分子中含有6个碳氢σ键,2个碳碳σ键,1个碳氧σ键,共有9个σ键,1个碳氧π键;
②甲醛分子中含有碳氧双键;甲醛分子与水分子之间可以形成氢键;
(3)以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置;以体心的Ti原子研究,其周围有6个N原子;依据均摊法计算。
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d2,由电子排布式可知,电子占据的最高能层符号为M,该能层具有的原子轨道数为(1+3+5)=9,故答案为:M;9;
②BH4-中B原子的价层电子对数为4,孤电子对数为0,则BH4-的空间构型为正四面体形;非金属性越强,电负性越大,金属性越强,电负性越小,Li为金属元素,非金属性H元素大于B元素,则电负性强弱顺序为H>B>Li,故答案为:正四面体;H>B>Li;
③TiCl4在常温下是无色液体,说明沸点低,属于分子晶体,故答案为:分子晶体;
(2)①丙酮分子中含有碳氧双键,1个丙酮分子中含有6个碳氢σ键,2个碳碳σ键,1个碳氧σ键,共有9个σ键,1个碳氧π键,则分子中含有π键与σ键数目之比为1:9,故答案为:1:9;
②甲醛分子中含有碳氧双键,则碳原子轨道的杂化类型为sp2杂化;甲醛分子与水分子之间可以形成氢键,氢键的存在能够大大增强物质的溶解性,故答案为:甲醛与水分子之间形成氢键;
(3)以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故与之距离相等且最近的N原子为![]() =12;以体心的Ti原子研究,其周围有6个N原子,配位数为6,;根据均摊法,可知该晶胞中N原子个数为:6×
=12;以体心的Ti原子研究,其周围有6个N原子,配位数为6,;根据均摊法,可知该晶胞中N原子个数为:6×![]() +8×
+8×![]() =4,该晶胞中Ti原子个数为:1+12×
=4,该晶胞中Ti原子个数为:1+12×![]() =4,晶胞的质量为
=4,晶胞的质量为![]() mol×62g/mol=(2a×10-7)3cm3×ρ,ρ=
mol×62g/mol=(2a×10-7)3cm3×ρ,ρ=![]() g/cm3。
g/cm3。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
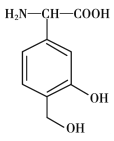
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是

A. 用装置甲分离出溴苯 B. 用装置乙验证乙炔的还原性
C. 用装置丙制取乙烯 D. 用装置丁制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_______________;
(2)Y元素原子的价层电子的轨道表示式为_____________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G7种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外均有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的主族元素。
(1)A的名称是____________,B位于周期表中第_________周期________族,C的原子结构示意图是________________。
(2)E的单质颜色是____________________。
(3)A元素与D元素形成的化合物的电子式是__________________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是_____________________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是________(填化学式,下同),酸性最强的是_______________,气态氢化物最稳定的是______________。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某橙色含结晶水的盐X的组成和性质,设计并完成如图实验。请回答:

(1)X的化学式是___。
(2)乙化学性质与其组成元素的单质相似,下列物质中能与乙发生反应的是__(填写相应的字母)。
A.Mg B.CaCl2 C.NaOH D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。

下列有关说法正确的是
A .正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中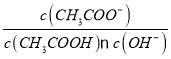 不变
不变
B.溶液中导电粒子的数目减少
C.醋酸的电离程度增大,c(H+)亦增大
D.完全致中和醋酸需加入10mLpH=11的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 乙酸与碳酸钠溶液反应:2H++CO32—== CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O →2C6H5OH+CO32—
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-![]() CO32—+2NH4++4Ag↓+6NH3+2H2O
CO32—+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com