
科目: 来源: 题型:
【题目】如图所示是由4个碳原子结合成的4种有机物(氢原子没有画出)
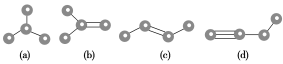
(1)写出有机物(a)的系统命名法的名称________________________。
(2)有机物(a)有一种同分异构体,试写出该同分异构体的结构简式________。
(3)上述有机物中与(c)互为同分异构体的是______(填代号)。
(4)任写一种与(d)互为同系物的有机物的结构简式________。
(5)(a)、(b)、(c)、(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)镍元素基态原子的价电子排布式为________;3d能级上的未成对的电子数为________。
(2)硫酸镍溶于氨水形成![]() 蓝色溶液,
蓝色溶液,![]() 中配体的空间构型是________,阴离子的空间立体构型是________。
中配体的空间构型是________,阴离子的空间立体构型是________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO________FeO(填“![]() ”或“
”或“![]() ”)。
”)。
(4)元素铜与镍的第二电离能分别为:I(Cu)=1959kJ/mol,I(Ni)=1753kJ/mol,I(Cu)> I(Ni)的原因是________。
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图甲所示。该合金的化学式为________。
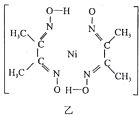
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图乙所示。该结构中,除共价键外还存在配位键和氢键。请在图中用“→”和“…”表示出配位键和氢键。(提示:Ni2+的配位数为4)________。
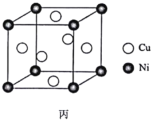
(7)某镍白铜合金的立方晶胞结构如图丙所示。若合金的密度为dg·cm-3,晶胞参数a=________nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.28g乙烯和环丙烷的混合气体中所含原子总数为6NA
B.1mol甘油(丙三醇)中含有羟基数为2.0NA
C.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJmol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJmol-1;
③H2O(g)=H2O(l) ΔH=ckJmol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
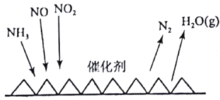
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=________mol/(Ls)。
②T1温度时,上述反应的化学平衡常数K=________。
③若将容器的温度改变为T2时其k正=k逆,则T1________T2(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
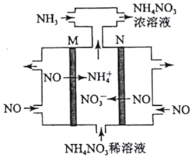
①N极的电极反应式为________________________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )

A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关事实及原因的分析中,错误的是![]()
![]()
事实 | 原因 | |
A. | 分子内不同化学键之间存在键角 | 共价键具有方向性 |
B. |
|
|
C. | 不含金属元素的化合物均是共价化合物 | 非金属元素间不能形成离子键 |
D. |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是___。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反应iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__(写化学方程式)反应的ΔH。
(3)反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于反应的计量数之比,目的是__(填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率__(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了__(写化学方程式)反应而使(1)中反应平衡向__移动。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是__,电源负极电极反应为___。“钝化”装置中阳极电极反应为___。

查看答案和解析>>
科目: 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目: 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
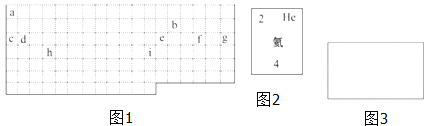
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com