
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.28g乙烯和环丙烷的混合气体中所含原子总数为6NA
B.1mol甘油(丙三醇)中含有羟基数为2.0NA
C.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
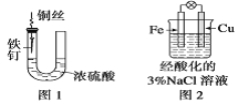

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
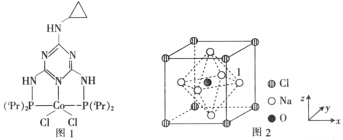
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成苯甲酸的原理、有关数据及装置示意图如图:

某学习小组在实验室制备、分离、提纯苯甲酸,步骤如下:
(一)制备苯甲酸
在三颈瓶中加入甲苯、水和沸石,搅拌并加热至沸腾,然后加入过量高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
(二)分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,减压过滤,再用少量冷水洗涤,干燥,得到粗产品。
请回答下列问题:
(1)装置a的名称是__,其作用为__。
(2)甲苯被高锰酸钾氧化的原理如下,请完成并配平该化学方程式。
________![]() +________KMnO4
+________KMnO4![]() ________
________![]() +________MnO2↓+________H2O+___________
+________MnO2↓+________H2O+___________
(3)分离提纯过程中为了除去过量的KMnO4,加入一种二元弱酸草酸,反应过程中有碳酸氢盐和无色气体生成。请用离子方程式表示反应原理__。
(4)产品减压过滤时用冷水洗涤的原因是__。
(5)选用下列_操作,可以将粗产品进一步提纯(选填字母)。
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(6)以酚酞为指示剂,用标准浓度KOH溶液滴定苯甲酸的乙醇溶液,可测定产品纯度,滴定终点的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是___。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反应iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__(写化学方程式)反应的ΔH。
(3)反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于反应的计量数之比,目的是__(填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率__(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了__(写化学方程式)反应而使(1)中反应平衡向__移动。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是__,电源负极电极反应为___。“钝化”装置中阳极电极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
![]()
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组由有机物A制备G的合成路线如图所示:

请回答下列问题:
(1)A的结构简式为________;D中含氧官能团的名称是________。
(2)反应③的试剂和反应条件分别是________,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________。
(4)反应⑤的化学方程式为________。
(5)G的相对分子质量为________。
(6)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有________种。
(7)参照上述合成路线,以![]() 和
和![]()
![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]()
![]()
![]() 的路线为________(其他无机试剂任选)。
的路线为________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )

A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(![]() )<3c(CH3COO-)+c(CH3COOH)
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(![]() )>c(CH3COO-)>c(H+)
)>c(CH3COO-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com