
【题目】25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )

A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(![]() )<3c(CH3COO-)+c(CH3COOH)
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(![]() )>c(CH3COO-)>c(H+)
)>c(CH3COO-)>c(H+)
【答案】C
【解析】
A.盐酸和CH3COONH4溶液反应生成醋酸和氯化铵,反应终点溶液为酸性,用甲基橙作滴定指示剂,A错误;
B.滴定过程中CH3COO-的浓度减小,对水的电离促进作用减弱,水的电离程度减小,B错误;
C.P点溶液中电荷守恒:c(CH3COO-)+c(OH-)+c(Cl-)=c(NH4+)+c(H+),物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Cl-),①式乘以2,和②式相加,得到:2c(H+)+2c(![]() )=3c(CH3COO-)+c(CH3COOH)+2c(OH-),P点溶液呈酸性,c(H+)>c(OH-),所以2c(
)=3c(CH3COO-)+c(CH3COOH)+2c(OH-),P点溶液呈酸性,c(H+)>c(OH-),所以2c(![]() )<3c(CH3COO-)+c(CH3COOH),C正确;
)<3c(CH3COO-)+c(CH3COOH),C正确;
D.Q点溶液中溶质为物质的量之比为1:1的醋酸和氯化铵,铵根离子水解,则c(Cl-)>c(![]() ),因醋酸电离程度小且水也电离出氢离子,则c(
),因醋酸电离程度小且水也电离出氢离子,则c(![]() )>c(H+)>c(CH3COO-),所以c(Cl-)>c(
)>c(H+)>c(CH3COO-),所以c(Cl-)>c(![]() )>c(H+)>c(CH3COO-),D错误;
)>c(H+)>c(CH3COO-),D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.28g乙烯和环丙烷的混合气体中所含原子总数为6NA
B.1mol甘油(丙三醇)中含有羟基数为2.0NA
C.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。电池的总反应为:3Zn+2![]() +8H2O
+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
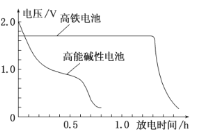
A.放电过程中正极区域电解液pH升高
B.高铁电池比高能碱性电池电压稳定、放电时间长
C.充电时,每转移3mol电子就有1molFe(OH)3被氧化
D.放电时负极反应式为:Zn+2e-+2H2O=Zn(OH)2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
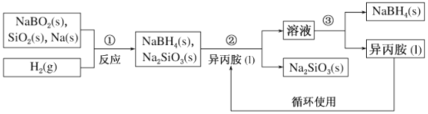
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
pH | 8 | 10 | 12 | 1 4 |
温度/℃ | 25 | 25 | 25 | 25 |
时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
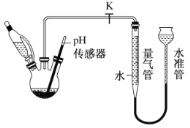
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH→CH3COO+CH3CH2O+H2O
B. 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
D. 乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH![]() CH3COO+ Cu2O↓+3H2O
CH3COO+ Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物a、b、c的分子式均为C8H8,其结构如图所示,下列说法正确的是( )

A.b的同分异构体可能与苯互为同系物
B.c苯环上的二氯代物有10种
C.a能与溴水反应,反应类型为取代反应
D.c中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是( )
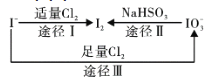
A.氧化性的强弱顺序为:Cl2>IO3->I2
B.途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
C.一定条件下,I-与IO3-反应可能生成I2
D.向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
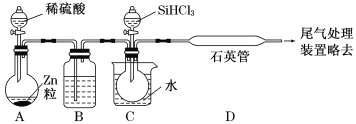
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com