
【题目】高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。电池的总反应为:3Zn+2![]() +8H2O
+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
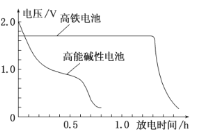
A.放电过程中正极区域电解液pH升高
B.高铁电池比高能碱性电池电压稳定、放电时间长
C.充电时,每转移3mol电子就有1molFe(OH)3被氧化
D.放电时负极反应式为:Zn+2e-+2H2O=Zn(OH)2+2H+
【答案】D
【解析】
A.放电时,失电子化合价升高的金属为负极材料,负极反应为:3Zn-6e-+6OH-=3Zn(OH)2,放电时,正极上得电子发生还原反应,电池反应式减去负极电极反应式得到正极电极反应式:2![]() +6e-+8H2O=2Fe(OH)3+10OH-,正极区域电解液pH升高,故A正确;
+6e-+8H2O=2Fe(OH)3+10OH-,正极区域电解液pH升高,故A正确;
B.据图可以看出高铁电池比高能碱性电池电压稳定,放电时间长,故B正确;
C.充电时,在阳极上发生反应:2Fe(OH)3-6e-+10OH-=2![]() +8H2O,每转移3mol电子,则有1 mol Fe(OH)3被氧化,故C正确;
+8H2O,每转移3mol电子,则有1 mol Fe(OH)3被氧化,故C正确;
D.放电时,失电子化合价升高的金属为负极材料,根据总反应可知负极反应为:3Zn-6e-+6OH-=3Zn(OH)2,故D错误;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
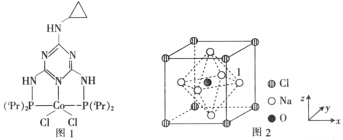
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组由有机物A制备G的合成路线如图所示:

请回答下列问题:
(1)A的结构简式为________;D中含氧官能团的名称是________。
(2)反应③的试剂和反应条件分别是________,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________。
(4)反应⑤的化学方程式为________。
(5)G的相对分子质量为________。
(6)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有________种。
(7)参照上述合成路线,以![]() 和
和![]()
![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]()
![]()
![]() 的路线为________(其他无机试剂任选)。
的路线为________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,写出电解饱和食盐水总离子方程式_________
下列说法正确的是__________

A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 LCl2,便产生2 molNaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3 溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 ![]() O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为________________________。
②电解制高铁酸钾时阳极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是![]()
![]()
①质子数相同的微粒一定属于同一种元素![]()
②同位素的性质相同![]()
③质子数相同、电子数也相同的微粒,不可能是一种分子和一种离子![]()
④电子数相同的微粒不一定是同一种元素![]()
⑤一种元素只能有一种质量数![]()
⑥某种元素的相对原子质量取整数,就是其质量数![]()
⑦![]() 中
中![]() 与
与![]() 的原子个数之比与NaCl中的
的原子个数之比与NaCl中的![]() 与
与![]() 的原子个数之比相等
的原子个数之比相等
A.②③⑤⑥⑦B.①②④⑤C.①②⑤⑥D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:________。
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、
H、![]() C、
C、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
①以上8种微粒共有________种核素,共________种元素。
②互为同位素的是________。
③质量数相等的是________和________,中子数相等的是________和________。
(3)相同物质的量的![]() 与
与![]() 的质量之比为________;中子数之比为________;电子数之比为________。
的质量之比为________;中子数之比为________;电子数之比为________。
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是______________。(铷的相对原子质量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )

A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(![]() )<3c(CH3COO-)+c(CH3COOH)
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(![]() )>c(CH3COO-)>c(H+)
)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是

A.a—b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d—e溶液中离子的物质的量:Ba2+不可能等于OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com