
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
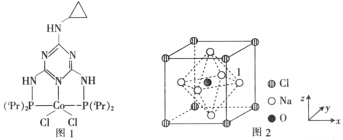
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
【答案】Ⅷ [Ar]3d84s2 > sp2 NH3 NH3分子间能形成氢键 Na3OCl 3 ![]()
【解析】
(1)Fe、Co、Ni均位于元素周期表的第四周期Ⅷ族,其中Ni为28号,其基态Ni原子的核外电子排布式为[Ar]3d84s2;基态Zn原子的核外电子排布式为[Ar]3d104s2,d能级全充满,较稳定,基态Co原子的核外电子排布式为[Ar]3d74s2,d能级未达到全充满,故第一电离能I1(Zn)>I1(Co);
(2)钴(Co)金属催化剂的结构中,六元环上的N原子的杂化方式为sp2;NH3分子之间存在氢键,所以NH3的熔沸点在同主族元素氢化物中是反常的,所以NH3、PH3中沸点更高的是NH3;
(3)根据反钙钛矿晶体结构可计算出其一个晶胞中的各原子的个数,Cl:![]() ,Na:
,Na:![]() ,O:
,O:![]() ,所以反钙钛矿的化学式为Na3OCl;晶胞中,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有:Na(0.5,0,0.5)、Na(0.5,1,0.5)、O(0.5,0.5,0.5),共3个;晶胞边长为a nm,即为a×10-7cm,NA为阿伏加德罗常数的值,所以该晶胞的密度为
,所以反钙钛矿的化学式为Na3OCl;晶胞中,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有:Na(0.5,0,0.5)、Na(0.5,1,0.5)、O(0.5,0.5,0.5),共3个;晶胞边长为a nm,即为a×10-7cm,NA为阿伏加德罗常数的值,所以该晶胞的密度为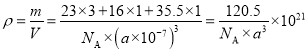 g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.钠着火可以用水扑灭
B.氯气能与铁反应,所以液氯不宜贮存在钢瓶中
C.漂白粉露置于空气中会变质的反应涉及到氧化还原反应
D.FeCl3既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图及有关说法正确的是( )
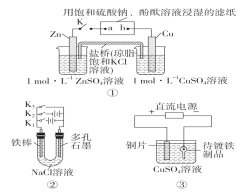
A.装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大
B.装置①中K键闭合时,片刻后可观察到滤纸a点变红色
C.装置②中铁腐蚀的速率由大到小顺序是:只闭合K1>只闭合K3>只闭合K2>都断开
D.装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA
查看答案和解析>>
科目:高中化学 来源: 题型:
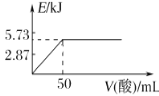
【题目】酸碱中和滴定是中学化学的定量检测手段之一。小豆在学习相关内容后,发现一个问题:能不能检测出家用白醋中醋酸的浓度。于是他设计了以下步骤(假设白醋中只有醋酸能与氢氧化钠反应):
(1)配制100mL1mol/L氢氧化钠标准溶液,此过程中需要的玻璃仪器为___。
(2)将___(填仪器名称)用水洗净并用氢氧化钠标准溶液润洗后,加入氢氧化钠标准溶液至零刻度,固定在滴定管夹上,用___(填仪器名称)准确量取20.00ml白醋置于锥形瓶中,并在锥形瓶中加入适量酚酞溶液。
(3)进行滴定。请写出滴定终点时的现象:___。
(4)多次测定后,平均消耗氢氧化钠的体积为16.00mL,则白醋中醋酸浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3kJ·mol-1,②H2(g)+![]() O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
A.向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
C.氢气的燃烧热为 ΔH=-241.8kJ·mol-1
D.氢气的燃烧热为 ΔH=-483.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积不变的密闭容器中发生化学反应:Fe2O3(s)+2NH3(g)![]() 2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )
2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )

A.NH3是正反应的还原剂
B.气体压强P2>P1
C.平衡后再充入一定量NH3,则平衡左移,NH3的体积分数减小
D.M点的平衡常数Kp=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5mol·L1CH3COONa溶液、0.5mol·L1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法不正确的是( )

A.当温度为50℃时,纯水中c(H+)=c(OH)
B.随温度升高,CuSO4溶液的c(H+)增大
C.随温度升高,CH3COONa溶液的pH变化与Kw改变有关
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.28g乙烯和环丙烷的混合气体中所含原子总数为6NA
B.1mol甘油(丙三醇)中含有羟基数为2.0NA
C.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
D.标准状况下,2.24L己烷含有分子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。电池的总反应为:3Zn+2![]() +8H2O
+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
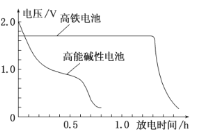
A.放电过程中正极区域电解液pH升高
B.高铁电池比高能碱性电池电压稳定、放电时间长
C.充电时,每转移3mol电子就有1molFe(OH)3被氧化
D.放电时负极反应式为:Zn+2e-+2H2O=Zn(OH)2+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com