
【题目】酸碱中和滴定是中学化学的定量检测手段之一。小豆在学习相关内容后,发现一个问题:能不能检测出家用白醋中醋酸的浓度。于是他设计了以下步骤(假设白醋中只有醋酸能与氢氧化钠反应):
(1)配制100mL1mol/L氢氧化钠标准溶液,此过程中需要的玻璃仪器为___。
(2)将___(填仪器名称)用水洗净并用氢氧化钠标准溶液润洗后,加入氢氧化钠标准溶液至零刻度,固定在滴定管夹上,用___(填仪器名称)准确量取20.00ml白醋置于锥形瓶中,并在锥形瓶中加入适量酚酞溶液。
(3)进行滴定。请写出滴定终点时的现象:___。
(4)多次测定后,平均消耗氢氧化钠的体积为16.00mL,则白醋中醋酸浓度为___。
【答案】烧杯、玻璃棒、量筒、胶头滴管、100mL容量瓶 碱式滴定管 酸式滴定管 滴入最后一滴标准液后溶液由无色变为淡红色,且半分钟内不褪色 0.8mol/L
【解析】
(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器:烧杯、玻璃棒、量筒、胶头滴管、100mL容量瓶;
(2)氢氧化钠溶液显碱性,应盛放在碱式滴定管中;白醋显酸性,应盛放在酸式滴定管中;
(3)本实验是用氢氧化钠溶液滴定白醋,开始时溶液显酸性,滴定终点溶质为醋酸钠,溶液显碱性,酚酞作指示剂,所以滴定终点现象为:滴入最后一滴标准液后溶液由无色变为淡红色,且半分钟内不褪色;
(4)![]() =0.8mol/L。
=0.8mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是物质的量的单位,1mol任何物质都含有6.02×1023个分子
B.钠元素和氯元素在自然界存在的形态既有游离态又有化合态
C.气体的体积主要由气体物质的量的多少和气体分子间的平均距离决定的
D.若1克水中含有m个氢原子,则阿伏加德罗常数用含m的代数式可表示为18m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
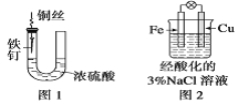

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是中学化学中的重要物质。小明通过自主学习成功地制取并提纯了乙酸乙酯:
小明的知识储备:
①乙醇能和氯化钙形成CaCl2·6C2H5OH
②有关物质的沸点:
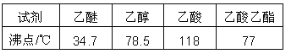
制备过程:
装置如图所示,A中放有浓硫酸,B中放有10mL无水乙醇和5mL冰醋酸,D中放有滴有酚酞的饱和碳酸钠溶液。迅速升温到170℃进行反应。
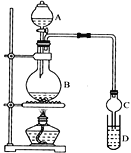
(1)请补充出乙酸与乙醇发生酯化反应的化学方程式___。
(2)实验装置还缺少___。
(3)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是___。(填字母)
A.25mL B.50mL C.250mL D.500mL
(4)小明在D中观察到了明显的的分层现象,其下层显___色。
产品提纯:
①将D中混合物转入分液漏斗进行分液。②有机层用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。③将粗产物蒸馏,收集馏分,得到纯净干燥的乙酸乙酯。
(5)操作②的目的为洗去___,操作③中,应收集___℃馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)具有强还原性,在工业生产上广泛用于非金属及金属材料的化学镀膜、贵金属回收、工业废水处理等。工业上采用的Bayer法制备NaBH4通常分两步(如图)。下列说法错误的是
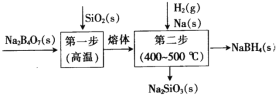
A.用B2O3代替Na2B4O7也可制得NaBH4
B.两步的总反应中氧化剂与还原剂的物质的量之比为2:1
C.将SiO2粉碎能增大得到熔体的速率
D.由图可知该工艺过程中无污染性物质产生,符合绿色化学理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
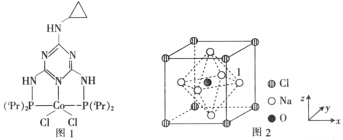
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成苯甲酸的原理、有关数据及装置示意图如图:

某学习小组在实验室制备、分离、提纯苯甲酸,步骤如下:
(一)制备苯甲酸
在三颈瓶中加入甲苯、水和沸石,搅拌并加热至沸腾,然后加入过量高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
(二)分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,减压过滤,再用少量冷水洗涤,干燥,得到粗产品。
请回答下列问题:
(1)装置a的名称是__,其作用为__。
(2)甲苯被高锰酸钾氧化的原理如下,请完成并配平该化学方程式。
________![]() +________KMnO4
+________KMnO4![]() ________
________![]() +________MnO2↓+________H2O+___________
+________MnO2↓+________H2O+___________
(3)分离提纯过程中为了除去过量的KMnO4,加入一种二元弱酸草酸,反应过程中有碳酸氢盐和无色气体生成。请用离子方程式表示反应原理__。
(4)产品减压过滤时用冷水洗涤的原因是__。
(5)选用下列_操作,可以将粗产品进一步提纯(选填字母)。
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(6)以酚酞为指示剂,用标准浓度KOH溶液滴定苯甲酸的乙醇溶液,可测定产品纯度,滴定终点的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com