
【题目】已知:①H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3kJ·mol-1,②H2(g)+![]() O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
O2(g)=H2O(g) ΔH2=-241.8kJ·mol-1,下列有关说法正确的是( )
A.向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
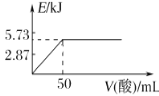
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
C.氢气的燃烧热为 ΔH=-241.8kJ·mol-1
D.氢气的燃烧热为 ΔH=-483.6kJ·mol-1
科目:高中化学 来源: 题型:
【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
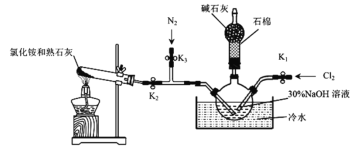
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中从海水提取镁的流程如图所示:

下列说法错误的是( )
A.石灰乳可由贝壳制得
B.“蒸发”时不能直接将水全部蒸干
C.“一定条件”是将氯化镁晶体配制成饱和溶液
D.以上操作过程中有两处涉及到氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)具有强还原性,在工业生产上广泛用于非金属及金属材料的化学镀膜、贵金属回收、工业废水处理等。工业上采用的Bayer法制备NaBH4通常分两步(如图)。下列说法错误的是
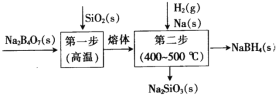
A.用B2O3代替Na2B4O7也可制得NaBH4
B.两步的总反应中氧化剂与还原剂的物质的量之比为2:1
C.将SiO2粉碎能增大得到熔体的速率
D.由图可知该工艺过程中无污染性物质产生,符合绿色化学理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
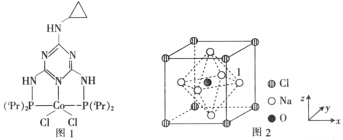
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
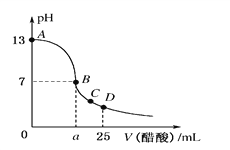
A. 在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-)
B. 在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. 在C点:c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
D. 在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是___。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反应iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__(写化学方程式)反应的ΔH。
(3)反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于反应的计量数之比,目的是__(填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率__(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了__(写化学方程式)反应而使(1)中反应平衡向__移动。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是__,电源负极电极反应为___。“钝化”装置中阳极电极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,写出电解饱和食盐水总离子方程式_________
下列说法正确的是__________

A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 LCl2,便产生2 molNaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3 溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 ![]() O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为________________________。
②电解制高铁酸钾时阳极的电极反应式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com