
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
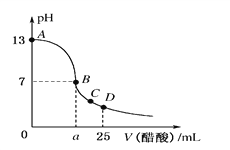
A. 在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-)
B. 在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. 在C点:c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
D. 在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确确是
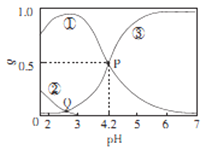
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
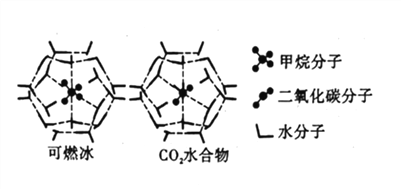
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
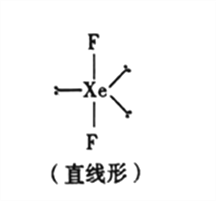
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3-D.NH4+、SO42-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产和社会发展密切相关。下列说法正确的是
A. 《天工开物》中“凡石灰,经火焚炼而用”里的石灰,指的是Ca(OH)2
B. 某品牌的八宝粥不含任何糖类物质,糖尿病人可以放心食用
C. 未成熟的苹果肉遇碘酒变蓝,成熟苹果的汁液不能与银氨溶液反应
D. 用氯化铁溶液洗涤银镜反应后的试管比用硫酸铁溶液效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 9gD2O中含有的电子数为5NA
B. 氢氧化铁胶体带正电荷。用含0.1mol的FeCl3溶液制成的氢氧化铁胶体中,胶粒数小于0.1NA
C. 常温下,7.8gNa2O2与100mL0.05mol/L的HCl溶液反应,产生的气体体积大于1120mL
D. 0.1mol/LNa2CO3溶液中:H2CO3、CO32-、HCO3-物质的量之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g。
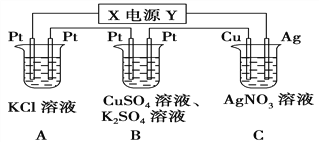
(1)电源电极X的名称为________;
(2)A中发生的离子方程式为_______________________
(3)B中阳极的电极反应式为___________________________
(4)pH变化:A_______,B_______,C_______。(填“增大”“减小”或“不变”)
(5)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为______________(设电解前后溶液体积无变化)。
(6)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为_______(设电解前后溶液体积无变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
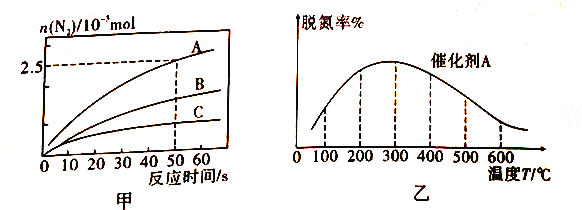
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. 0.1mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
B. 0.1mol·L-1NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
C. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4)+2c(H2C2O4)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com