
【题目】在一体积不变的密闭容器中发生化学反应:Fe2O3(s)+2NH3(g)![]() 2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )
2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )

A.NH3是正反应的还原剂
B.气体压强P2>P1
C.平衡后再充入一定量NH3,则平衡左移,NH3的体积分数减小
D.M点的平衡常数Kp=![]()
【答案】C
【解析】
由题图可知,随温度升高,氨的体积分数降低,平衡正向移动,正反应是吸热反应,该反应的△H>0,升温平衡正向移动;Fe2O3(s) +2NH3(g)![]() 2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动。
2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动。
A.正反应中,由NH3转化为N2,可见N由-3价变为0价,NH3是正反应的还原剂,A正确;
B.由于Fe2O3(s) +2NH3(g)![]() 2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动,氨的体积分数增大,气体压强p2 >p1, B正确;
2Fe(s) +N2(g) +3H2O(g)是气体体积增大的反应,加压平衡逆向移动,氨的体积分数增大,气体压强p2 >p1, B正确;
C.平衡后再充入一定量NH3,容器体积不变,则相当于增大NH3的浓度,则平衡右移,NH3的体积分数减小, C错误;
D.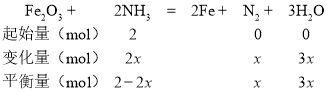
假设起始通入2mol NH3,M点时氨气的体积分数为25%,得到(2-2x)/(2+2x)=0.25,x=0.6,气体总物质的量=2mol+2x mol=3.2mol,图中M点的平衡常数为:
Kp=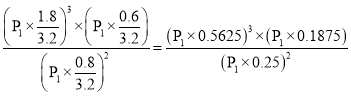 ,D正确;
,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是中学化学中的重要物质。小明通过自主学习成功地制取并提纯了乙酸乙酯:
小明的知识储备:
①乙醇能和氯化钙形成CaCl2·6C2H5OH
②有关物质的沸点:
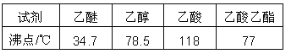
制备过程:
装置如图所示,A中放有浓硫酸,B中放有10mL无水乙醇和5mL冰醋酸,D中放有滴有酚酞的饱和碳酸钠溶液。迅速升温到170℃进行反应。
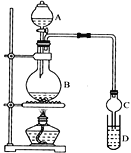
(1)请补充出乙酸与乙醇发生酯化反应的化学方程式___。
(2)实验装置还缺少___。
(3)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是___。(填字母)
A.25mL B.50mL C.250mL D.500mL
(4)小明在D中观察到了明显的的分层现象,其下层显___色。
产品提纯:
①将D中混合物转入分液漏斗进行分液。②有机层用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。③将粗产物蒸馏,收集馏分,得到纯净干燥的乙酸乙酯。
(5)操作②的目的为洗去___,操作③中,应收集___℃馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸盐被广泛用作肥料和氧化剂。有学者最新研究发现氮在ZnFe0.4Co1.6O4上直接电化学氧化可生成硝酸盐。回答下列问题:
(1)Fe、Co、Ni均位于元素周期表第_________族,其中基态Ni原子的核外电子排布式为_________;Zn与Co的第一电离能I1(Zn)__________(填“<”或“>”)I1(Co)。
(2)图1是一种钴(Co)金属催化剂的结构,其中六元环上的N原子的杂化方式为_________;NH3、PH3中沸点更高的是_________,原因是_____________________________________。
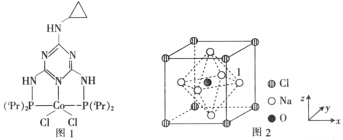
(3)一种由O、Na、C1元素构成的良好的离子导体,具有反钙钛矿晶体结构(如图2),则其化学式为_______________________,设其晶胞边长为anm,NA为阿伏加德罗常数的值,1号Na原子的坐标为(1,0.5,0.5),则沿y轴向原点投影至x-z平面,坐标为(0.5,0.5)的原子有_______个,该晶胞的密度为_________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。锂离子电池广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜中主要含有钴酸锂(LiCoO2)、Al等,处理该废料的一种工艺如下图所示:

回答下列问题:
(1)铝钴膜在处理前初步进行粉碎的目的是________________________。
(2)能够提高“碱浸”效率的方法有________________________(至少写两种)。
(3)“碱浸”时Al溶解的离子方程式为________________________。
(4)“酸溶”时加入H2O2的目的是________________________。
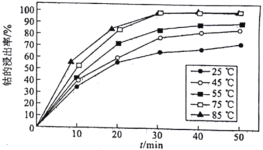
(5)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是_______________________。
(6)配制250 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外还需要________。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该钴的氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成苯甲酸的原理、有关数据及装置示意图如图:

某学习小组在实验室制备、分离、提纯苯甲酸,步骤如下:
(一)制备苯甲酸
在三颈瓶中加入甲苯、水和沸石,搅拌并加热至沸腾,然后加入过量高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
(二)分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,减压过滤,再用少量冷水洗涤,干燥,得到粗产品。
请回答下列问题:
(1)装置a的名称是__,其作用为__。
(2)甲苯被高锰酸钾氧化的原理如下,请完成并配平该化学方程式。
________![]() +________KMnO4
+________KMnO4![]() ________
________![]() +________MnO2↓+________H2O+___________
+________MnO2↓+________H2O+___________
(3)分离提纯过程中为了除去过量的KMnO4,加入一种二元弱酸草酸,反应过程中有碳酸氢盐和无色气体生成。请用离子方程式表示反应原理__。
(4)产品减压过滤时用冷水洗涤的原因是__。
(5)选用下列_操作,可以将粗产品进一步提纯(选填字母)。
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(6)以酚酞为指示剂,用标准浓度KOH溶液滴定苯甲酸的乙醇溶液,可测定产品纯度,滴定终点的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
![]()
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是![]()
![]()
①质子数相同的微粒一定属于同一种元素![]()
②同位素的性质相同![]()
③质子数相同、电子数也相同的微粒,不可能是一种分子和一种离子![]()
④电子数相同的微粒不一定是同一种元素![]()
⑤一种元素只能有一种质量数![]()
⑥某种元素的相对原子质量取整数,就是其质量数![]()
⑦![]() 中
中![]() 与
与![]() 的原子个数之比与NaCl中的
的原子个数之比与NaCl中的![]() 与
与![]() 的原子个数之比相等
的原子个数之比相等
A.②③⑤⑥⑦B.①②④⑤C.①②⑤⑥D.③④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com