
【题目】下列轨道表示式表示的元素原子中,能量处于最低状态的是( )
A.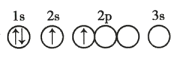 B.
B.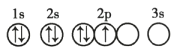
C. D.
D.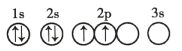
【答案】D
【解析】
洪特规则:即电子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道,因为这种排布方式原子的总能量最低,所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道;泡利不相容原理:指的是在原子中不能容纳运动状态完全相同的两个电子;能量最低原理:原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里。
A.2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道,不符合能量最低原理,故A错误;
B.2p能级的3个简并轨道(能级相同的轨道)只有被电子逐一自旋平行的占据后,才能容纳第二个电子,违背洪特规则,故B错误;
C.2s能级的能量比2p、3s能量低,电子尽可能占据能量最低的轨道,不符合能量最低原理,故C错误;
D.能级能量由低到高的顺序为:1s、2s、2p,每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子处于基态,其能量最低,故D正确;
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制高纯氢的方法之一。
(1)反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是___。
(2)已知反应器中还存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
iii.CH4(g)=C(s)+2H2(g) ΔH3
……
反应iii为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__(写化学方程式)反应的ΔH。
(3)反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于反应的计量数之比,目的是__(填字母)。
a.促进CH4转化 b.促进CO转化为CO2 c.减少积炭生成
(4)用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如图所示。从t1时开始,H2体积分数显著降低,单位时间CaO消耗率__(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,因为此时CaO主要发生了__(写化学方程式)反应而使(1)中反应平衡向__移动。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质a是__,电源负极电极反应为___。“钝化”装置中阳极电极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,写出电解饱和食盐水总离子方程式_________
下列说法正确的是__________

A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 LCl2,便产生2 molNaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3 溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 ![]() O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为________________________。
②电解制高铁酸钾时阳极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:________。
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、
H、![]() C、
C、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
①以上8种微粒共有________种核素,共________种元素。
②互为同位素的是________。
③质量数相等的是________和________,中子数相等的是________和________。
(3)相同物质的量的![]() 与
与![]() 的质量之比为________;中子数之比为________;电子数之比为________。
的质量之比为________;中子数之比为________;电子数之比为________。
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是______________。(铷的相对原子质量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
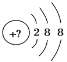
(1)该微粒是中性微粒,这种微粒的符号是________。
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________。
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒的符号是________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )

A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(![]() )<3c(CH3COO-)+c(CH3COOH)
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(![]() )>c(CH3COO-)>c(H+)
)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种古老的抗疟疾和治疗阿米巴病药物种和物,也是一种治疗自身免疫性疾病的药物。2020年2月19日在《新型冠状病毒肺炎诊疗方案(试行第六版)》里面提出新增口服磷酸氯喳作为抗新冠病毒感染治疗用药。其中间体H的一种合成路线如下:
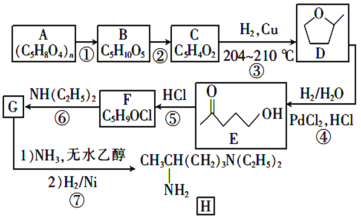
已知:A为半纤维素的一种,属于多糖,B为戊糖, B、C中均含有醛基;C中含有五元环状结构且含一种与D相同的官能团;C中不含碳碳三键。
(1)D中所含官能团的名称是______。
(2)①的反应试剂和条件是________。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出B的结构简式,用星号 (*)标出B中的手性碳原子______。
(4)C的结构简式为_______。
(5)⑤的反应类型是________,⑥的化学方程式为________。
(6)化合物W是E的同分异构体,W能发生水解反应,符合题意的W有_____种(不含立体结构),核磁共振氢谱只有两组峰的结构简式是________。
(7)设计以![]() (环氧丙烷)为原料制备
(环氧丙烷)为原料制备![]() 的合成路线(无机试剂任用)______。
的合成路线(无机试剂任用)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业含铝、铁、铜合金废料的再利用,某同学设计的回收利用方案如下:
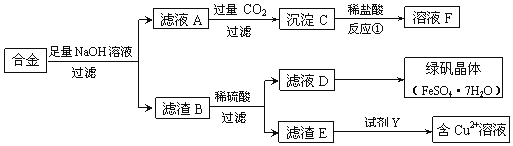
(1)合金与足量氢氧化钠溶液反应的离子方程式是______。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是______。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤:______、______、过滤、洗涤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y选用稀硝酸,则化学方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数。常温下,一定浓度的某酸(H2A)的水溶液中pC(H2A)、pC(HA-)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是( )

A.pH=3时,c(H2A)=c(A2-)>c(HA-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.HA-的水解平衡常数为10-12.7
D.任何时候,溶液中都存在:c(H+)=c(OH-)+c(HA-)+2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com