
科目: 来源: 题型:
【题目】在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。电池的总反应为:3Zn+2![]() +8H2O
+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
3Zn(OH)2+2Fe(OH)3+4OH-,下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断错误的是
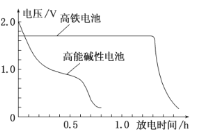
A.放电过程中正极区域电解液pH升高
B.高铁电池比高能碱性电池电压稳定、放电时间长
C.充电时,每转移3mol电子就有1molFe(OH)3被氧化
D.放电时负极反应式为:Zn+2e-+2H2O=Zn(OH)2+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图所示,下列说法错误的是

A.分子式为C8H7OClB.在同一平面上的碳原子最多有8个
C.1mol苯氯乙酮最多可与3molH2发生加成反应D.核磁共振氢谱有4个吸收峰
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.向AgNO3中滴加氨水至过量:Ag++NH3H2O=AgOH↓+![]()
B.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
C.向Na2S2O3溶液中加入足量稀硫酸:2![]() +4H+=
+4H+=![]() +3S↓+2H2O
+3S↓+2H2O
D.向苯酚钠溶液中通入少量CO2气体:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +
+![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】PPG是一种可降解的聚酷类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
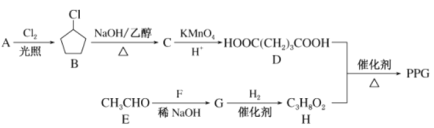
已知:R1CHO+R2CH2CHO![]()
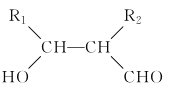
回答下列问题:
(1)G的结构简式为_________,B中含有官能团的名称为 _________。
(2)由B生成C的化学方程式为_________。
(3)H的化学名称为_________。
(4)由D和H生成PPG的化学方程式为_________。
(5)写出D的同分异构体中能同时满足下列条件的有机物结构简式:_________。
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生水解反应
③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
(6)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_________(填标号)
a.质谱仪 b.红外光谱仪c.元素分析仪d.核磁共振仪
(7)以E为起始原料合成![]() 选用必要的无机试剂,写出合成路线流程图:_________。合成路线流程图示例:H2C=CH2
选用必要的无机试剂,写出合成路线流程图:_________。合成路线流程图示例:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CH2Br。
CH3CH2Br。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,写出电解饱和食盐水总离子方程式_________
下列说法正确的是__________

A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 LCl2,便产生2 molNaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3 溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 ![]() O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
O3+3H2O2。则阳极的电极反应式为________________________,阴极的电极反应式为_________________________ 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为________________________。
②电解制高铁酸钾时阳极的电极反应式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上处理含苯酚废水的过程如下。回答下列问题:
I.测定废水中苯酚的含量。
测定原理:![]() +3Br2→
+3Br2→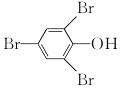 ↓+3HBr
↓+3HBr
测定步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.00mLamol/L浓溴水(过量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入bmL0.10mol/LKI溶液(过量),塞紧瓶塞,振荡。
步骤4:以淀粉作指示剂,用0.010mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V1mL。(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
把待测废水换为蒸馏水,重复上述各步骤(即进行空白实验),消耗Na2S2O3标准溶液V2mL(以上数据均已扣除干扰因素)。
(1)步骤1中量取待测废水所用仪器是_________。
(2)步骤2中塞紧瓶塞的原因是_________。
(3)步骤4中滴定终点的现象为_________。
(4)该废水中苯酚的含量为_________mg/L(用含V1、V2的代数式表示)。
(5)如果“步骤4”滴定至终点时仰视读数,则测得消耗Na2S2O3标准溶液的体积_____V1mL(填“偏大”、“偏小”或“无影响”,下同);如果空白实验中的“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量_________。
II.处理废水。
采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(OH),阴极上产生H2O2。通过交替排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(6)写出阳极的电极反应式:_________。
(7)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(本题10分)
(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为______。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水质量增加2.8g,此两种烃的组成为____(填分子式)。
(3)某烃是一种比水轻的油状液体,相对分子质量为78,碳元素与氢元素的质量比为12:1,不能使溴水和酸性高锰酸钾溶液褪色。写出此烃发生取代反应的化学方程式(任意写一个即可)___________。
(4)2.3g某有机物A完全燃烧后,生成0.1molCO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,已知此有机物可以与Na发生置换反应,写出此有机物与乙酸发生酯化反应的化学方程式______。
(5) 有机物的结构可用“键线式”表示,如:CH3-CH=CH-CH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,![]() ,苧烯的分子式为____。
,苧烯的分子式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下一些氧化物和单质之间可发生如下图所示的反应:其中,氧化物Ⅰ是红棕色固体,氧化物Ⅱ、Ⅲ、Ⅳ在反应条件下都是气体。
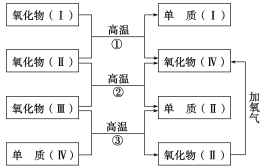
(1)氧化物Ⅰ的化学式是________,氧化物Ⅱ的化学式是________。
(2)反应①的化学方程式是_________;反应②的化学方程式_______;反应③的化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com