
科目: 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7)。
(1)用离子方程式表示该溶液中存在的三个平衡体系___、___、__。
(2)溶液中各离子的物质的量浓度由大到小顺序为___。
(3)溶液中粒子中浓度为0.1mol/L的是___,浓度为0.05mol/L的是__。
(4)物质的量之和为0.lmol的两种粒子是___与___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ba(AlO)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是

A.a—b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d—e溶液中离子的物质的量:Ba2+不可能等于OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g) ![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
(1)求x =____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时B的浓度为______。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A 单位时间内每消耗2 mol A,同时生成1molC
B 单位时间内每生成1molB,同时生成1mol C
C D的体积分数不再变化
D 混合气体的压强不再变化
E B、C的浓度之比为1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的密闭容器中,可逆反应N2 + 3H2![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A. N2、H2、NH3在容器中共存
B. 混合气体的总物质的量不再发生变化
C. 单位时间内生成n mol N2,同时生成3n mol H2
D. 单位时间内消耗n mol N2,同时消耗n mol NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃下,用pH传感器进行数字化实验,将VlmL0.1mol/L的AOH溶液与V2mL0.1mol/L的HB溶液按V1+V2=100mL混合,测得V1、V2与混合液pH关系如图(生成的AB可溶于水)。下列叙述正确的是

A.曲线I表示强酸HB
B.K点溶液中存在2c(A+)+c(H+)=2c(B-)+c(OH-)
C.电离平衡常数Ka(HB)>Kb(AOH)
D.从L点到M点,水的电离程度不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于环丁烷羧酸(![]() )的叙述正确的是
)的叙述正确的是
A.烃基上的六氯代物为3种(不考虑立体异构)B.可以发生加聚、取代、中和反应
C.所有的碳原子在同一平面内D.与2-甲基环丙烷羧酸互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铋片[主要成分(BiO)2CO3]可用于治疗慢性胃炎及缓解胃酸过多引起的胃病。由菱铋矿(主要成分为nBi2O3·mCO2·H2O,含杂质SiO2、CuS等)制备(BiO)2CO3的一种工艺如图:
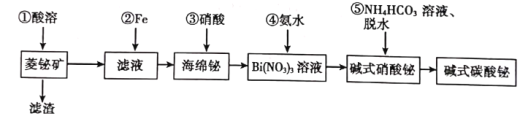
试回答下列问题:
(1)为提高①的“酸溶”速率,可以采取的措施是__________(任写一种)。
(2)①中酸溶解率与接触时间及溶液的pH之间的关系如图,据此分析,“酸溶”的最佳条件为__________;滤渣的主要成分是__________。
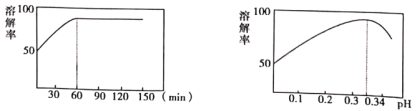
(3)“酸溶”后溶液必须保持强酸性,以防止铋元素流失,原理是__________。
(4)②中得到“海绵铋”的离子方程式为__________。
(5)④中反应的化学反应方程式为__________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Cu2+、Bi3+的混合溶液中滴加Na2S溶液,当Fe2+恰好沉淀完全时,所得溶液c(Cu2+):c(Bi3+)=__________。(忽略Na2S溶液所带来的体积变化)。
资料:①有关溶度积数据见表:
难溶物质 | FeS | CuS | Bi2S3 |
Ksp(25℃) | 6.3×10-18 | 6.3×10-36 | 1.6×10-20 |
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
查看答案和解析>>
科目: 来源: 题型:
【题目】某合金由选项中的两种或两种以上金属组成,为测定其组成,取10克该金属投入到足量的盐酸中充分反应后,生成的氢气在标准状况下体积为11.2L,则混合物中一定含有的金属是
A.锌B.铁C.铝D.镁
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com