
科目: 来源: 题型:
【题目】东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是

A.青铜是我国使用最早的合金、含铜、锡、铅等元素
B.青铜的机械性能优良,硬度和熔点均高于纯铜
C.铜器皿表面的铜绿可用明矾溶液清洗
D.“曾青(![]() )得铁则化为铜”的过程发生了置换反应
)得铁则化为铜”的过程发生了置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是

A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A.由图可知:乙酸的生成速率随温度升高而升高
B.250—300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C.由300—400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D.根据图像推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目: 来源: 题型:
【题目】向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)=____,该条件下的平衡常数K=____。
(2) 第15 min后,温度调整到T2,数据变化如上表所示,则T1___T2(填“>”、“<”或“=” )。
(3)若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、E、G均为气体,E是一种单质,G能导致硫酸型酸雨的形成;B是最常见的液体;C、F均为两性化合物;A由两种元素组成,其摩尔质量为150g·mol-1。
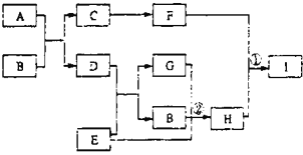
(1)A的化学式为________。
(2)酸雨是指PH小于________的雨水。
(3)写出C的一种用途________。
(4)写出反应①的离子方程式________。
(5)写出反应②的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+Cl2(g)![]() 2HCl(g)的反应能量变化示意图如下。下列说法不正确的是
2HCl(g)的反应能量变化示意图如下。下列说法不正确的是

A. 键的断裂过程是吸热过程,键的形成过程是放热过程
B. “假想的中间物质”的总能量高于起始态H2和Cl2的总能量
C. 反应的△H=[(a+b)-2c]kJ/mol
D. 点燃条件和光照条件下,反应的△H不同
查看答案和解析>>
科目: 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空(不用配平):C+________+H2SO4——________+______+Cr2(SO4)3+H2O。
(2)上述反应中氧化剂是(填化学式)________,被氧化的元素是(填元素符号)________。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)________。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2是中学化学中一种重要的物质。请回答下列问题:
Ⅰ.一定条件下,烧杯中H2O2溶液发生分解反应放出气体的体积和时间的关系如图所示:

则由D到A过程中,随着反应的进行反应速率逐渐_________(选填 “加快”或“减慢”),其变化的原因是________________________________________。
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。
(1)定性图甲可通过观察_________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______。

(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,实验中需要测量的数据是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x、(x=0或1),下列说法正确的是

A. 多孔碳材料电极为负极
B. 外电路电子由多孔碳材料电极流向锂电极
C. Li+向多孔碳材料区迁移
D. x=0时,正极反应式为:2Li++O2+4e-=Li2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com