
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、E、G均为气体,E是一种单质,G能导致硫酸型酸雨的形成;B是最常见的液体;C、F均为两性化合物;A由两种元素组成,其摩尔质量为150g·mol-1。
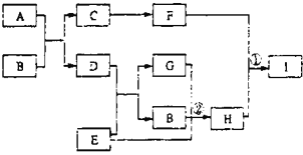
(1)A的化学式为________。
(2)酸雨是指PH小于________的雨水。
(3)写出C的一种用途________。
(4)写出反应①的离子方程式________。
(5)写出反应②的化学方程式________。
【答案】Al2S3 5.6 阻燃剂或治疗胃酸过多 Al2O3+6H+=2Al3++3H2O 2H2O+O2+2SO2=2H2SO4
【解析】
G能导致硫酸型酸雨的形成,G是SO2,B是最常见的液体,B是H2O,由图中转化关系可知D为H2S,E为O2,H为H2SO4,A由两种元素组成,由图中转化关系可知应为硫化物,其摩尔质量为150g·mol-1,且C、F均为两性化合物,可知A为Al2S3,C为Al(OH)3,F为Al2O3,I为Al2SO4 。
(1)由分析可知,A为Al2S3;
(2)正常雨水由于溶解有CO2,因此其pH为5.6;当雨水的pH<5.6时,则形成酸雨;
(3)由分析可知,C为Al(OH)3,可用于治疗胃酸过多;同时Al(OH)3受热分解产生Al2O3,Al2O3的熔点较高,故Al(OH)3也可做阻燃剂;
(4)反应①为Al2O3与H2SO4的反应,该反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
(5)反应②为SO2、O2与H2O的反应,该反应的化学方程式为:2SO2+O2+2H2O=2H2SO4;


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在标准状况下,11.2 L氖气含有NA个氖原子
B.1 mol -CH3中含有电子数为10NA
C.![]() mol的HCl分子所含分子数为
mol的HCl分子所含分子数为![]() NA
NA
D.标准状况下22.4 L H2中含中子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷是液化石油气主要成分之一,是一种优良的燃料。试回答下列问题:
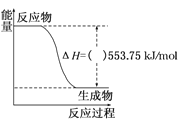
(1)如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”)_____。写出表示丙烷燃烧热的热化学方程式:_________________________
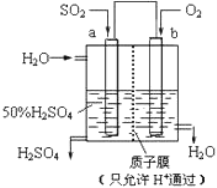
(2)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____________,b 是___________ 极(填“正”或“负”),b 电极反应式为______________________________,a 电极发生______________ (填“氧化反应”或“还原反应”)。②生产过程中H+向_____(填 a 或 b)电极区域运动。
(3)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极为负极,其电极反应式为:_______________________。电池在放电过程中,溶液的pH值将______________ 。(填“下降”“上升”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s) ![]() B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
①单位时间内生成2molA的同时生成1molB ②v (B): v (C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x、(x=0或1),下列说法正确的是

A. 多孔碳材料电极为负极
B. 外电路电子由多孔碳材料电极流向锂电极
C. Li+向多孔碳材料区迁移
D. x=0时,正极反应式为:2Li++O2+4e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用不同方法制得白色的Fe(OH)2沉淀。
(1)用未被氧化的FeSO4溶液与煮沸过的蒸馏水配制的NaOH溶液反应制备,制备过程中下列说法正确的是_______
A.用硫酸亚铁晶体配制上述FeSO4溶液时还需加入适量盐酸防止水解
B.除去蒸馏水中溶解的O2也可以采取振摇、静止的方法
C.生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液
D.FeSO4溶液上面加一层苯可以防止空气中氧气直接与溶液接触
(2)在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。在试管I 里加入稀H2SO4和铁屑,在试管II里加入NaOH溶液,打开止水夹,塞紧塞子,检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯浄时,再____(填操作步骤),这样一段时间后试管Ⅲ中制得的Fe(OH)2沉淀能较长时间保持白色,其理由是__________________。
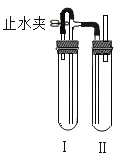
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中充分反应后向滤液中加入10 mol·L1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )
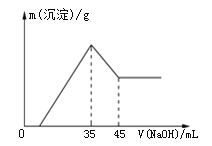
A.3.50 mol·L1B.0.85 mol·L1C.1.75 mol·L1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数与其内层电子数之比为7∶10,下列说法中不正确的是( )
![]()
A.最高价氧化物对应水化物的酸性:Y>Z
B.Y元素的两种同素异形体在常温下都是气体
C.原子半径由大到小排列顺序:Z>X>Y
D.阴离子半径由大到小排列顺序:Z>W>X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com