
【题目】如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数与其内层电子数之比为7∶10,下列说法中不正确的是( )
![]()
A.最高价氧化物对应水化物的酸性:Y>Z
B.Y元素的两种同素异形体在常温下都是气体
C.原子半径由大到小排列顺序:Z>X>Y
D.阴离子半径由大到小排列顺序:Z>W>X>Y
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)Z元素的名称是___。
(2)XZ3化合物的化学式是___,电子式是__。
(3)分别写出X、Y的含氧酸的化学式__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
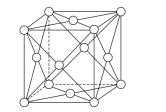
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(其中R是未知基团)在一定条件下可转化为如下系列物质。
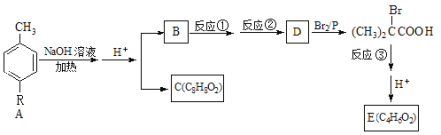
已知: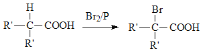 (R’为烷基)
(R’为烷基)
回答下列问题:
(1)A的结构简式___________________________;B的结构简式____________________。
(2)写出符合下列条件的C的一种同分异构体的结构简式_______________________。
(I)属于酯类;(II)苯环上只有一个取代基;(III)能发生银镜反应。
(3)检验反应②是否完全的方案是_______________________________________________。
(4)反应①反应类型是______________________________。
(5)写出反应③的化学方程式___________________________________________________。
(6) E可以合成高聚物,写出该高聚物的结构简式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa’处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是
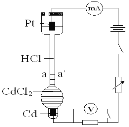
A.通电时,H+、Cd2+向Pt电极迁移,Cl-向Cd电极迁移
B.装置中总反应的化学方程式为:Cd + 2HCl![]() CdCl2 + H2↑
CdCl2 + H2↑
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物X有三种元素组成,某学习小组进行了如下实验:
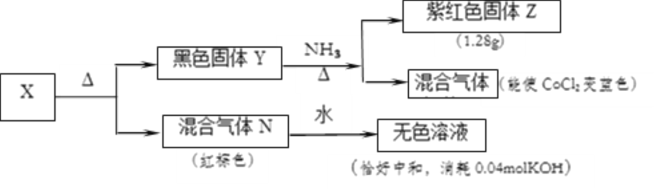
(1)化合物X的化学式为___________
(2)混合气体N通入足量的NaOH溶液中,恰好完全反应生成一种盐,其离子反应方程式为______________。
(3)黑色固体Y与NH3的化学方程式为____________
(4)若以X 3H2O进行实验,在170℃时可以生成一种中间产物W。 0.1mol化合物W能与0.6molHCl刚好完全反应,若0.1mol化合物W再继续加热生成黑色固体Y的质量为32.0g。则化合物W的化学式为______________。
(5)混合气体N有毒,为保护环境,可以用保险粉(Na2S2O4)吸收。请说明混合气体N能用保险粉吸收的理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,在20mL 0.1molL-1一元弱酸HA溶液中滴加同浓度的NaOH溶液,溶液中![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是
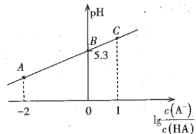
A.室温时,电离常数Ka(HA)=1.0×10-5.3
B.B点对应NaOH溶液的体积是10mL
C.A点溶液中:c(Na+)> c(A-)> c(H+)> c(OH-)
D.从A点到C点的过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块(NaHSO2·HCHO·2H2O)可用作印染工业的还原剂、橡胶合成及制糖工业中的漂白剂。以SO2、纯碱、Zn及甲醛为原料生产吊白块及氧化锌的工艺流程如图:
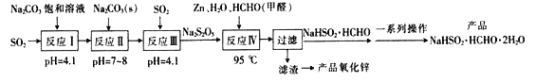
已知:吊白块呈白色块状固体成结晶性粉状,易溶于水,微溶于乙醇,常温时较为稳定,高温下下具有强还原性:120℃以上会分解产生甲醛、二氧化硫和硫化氢等有毒气体。
回答下列问题:
(1)“反应Ⅰ”发生后溶液的pH=4.1,则反应I的产物是__。
(2)设计反应Ⅱ后向反应Ⅲ中继续通入SO2的目的是得到NaHSO3过饱和溶液,从而生成Na2S2O5,则反应Ⅲ中发生反应的化学方程式为__。
(3)“反应Ⅳ”加热的方式最好选用__(填“直接加热”或“水浴加热”);其反应的化学方程式为__。
(4)“过滤”得到的滤液蒸发浓缩时不能在敞口容器中进行,原因是__;洗涤时中的洗涤剂最好选择__(填字母序号)。
A.水 B.无水乙醇 C.稀氢氧化钠溶液
(5)由“滤渣”制备氧化锌的方法是__。
(6)一种测定吊白块中硫的质量分数的方法如下:称取ag产品溶于适量水中,加入稍过量的碘水(反应生成NaHSO4和HCOOH),充分反应后加入足量BaCl2溶液,过滤,滤渣经干燥后称得质量为bg。则产品中硫的质量分数为__(用含a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com