
科目: 来源: 题型:
【题目】类推法在化学学习中经常采用,下列类推的结论正确的是( )
A.Cl2+2KBr= 2KCl+Br2,所以F2也能与KBr溶液反应置换出Br2
B.常温下,Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2
C.Cu+Cl2![]() CuCl2,所以Cu+I2
CuCl2,所以Cu+I2![]() CuI2
CuI2
D.钾保存在煤油中,所以钠也可以保存在煤油中
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生话密切相关。下列说法错误的是
A. 生活中用到的陶瓷,如日用器皿、建筑饰材、卫生活具等主要是传统硅酸盐陶瓷
B. 铝制餐具不宜用来蒸煮或长时间存放酸性和碱性食物,但可长时间存放咸的食物
C. 洗发时使用的护发素主要是调节头发的![]() ,使之达到适宜的酸碱度
,使之达到适宜的酸碱度
D. 煤的干馏、海带提碘、石油裂解、芒硝风化等都涉及化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲酸的酸性强于醋酸。
(1)醋酸铵溶液呈中性,则甲酸铵溶液的pH____7(填“>”、“<”或“=”);若HCOONH4、NH4HSO4、NH4Cl三种溶液中的c(NH4+)相同,则c(HCOONH4)、c(NH4Cl)、c(NH4HSO4)的由大到小的顺序是_____________________________________。
(2)常温下0.01 mol·L-1 的氨水中![]() ,该溶液的pH为_________。向0.01 mol·L-1的甲酸溶液中逐滴加入0.01 mol·L-1的氨水,该过程中的离子浓度关系不可能为__________。
,该溶液的pH为_________。向0.01 mol·L-1的甲酸溶液中逐滴加入0.01 mol·L-1的氨水,该过程中的离子浓度关系不可能为__________。
A.c(HCOO-)>c(H+)>c(NH4+)>c(OH-) B.c(HCOO-)> c(NH4+)> c(H+) >c(OH-)
C.c(HCOO-)= c(NH4+) > c(H+) =c(OH-) D.c(HCOO-)> c(NH4+)>c(OH-)> c(H+)
E.c(NH4+)>c(HCOO-)> c(OH-)>c(H+)
(3)如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂a附近的pH_______(填“增大”、“不变”或“减小”),催化剂b表面发生的电极反应式为___________________。
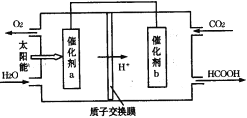
(4)常温下,0.02 mol·L-1的HCOONa溶液pH=8,则常温下HCOOH的电离常数Ka约为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
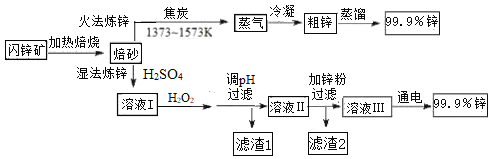
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所给信息和标志,判断下列说法错误的是( )
A | B | C | D |
碳酸氢钠药片
| 铜片制成的“纳米铜”在空气中易燃烧 |
| “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒 |
过量服用阿司匹林引起酸中毒后,可服用碳酸氢钠药片解毒 | 说明“钠米铜”的金属性比铜片强 | 看到有该标识的丢弃物,应远离并报警 | 在酿酒过程中,发生的反应有水解反应、氧化还原反应等 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
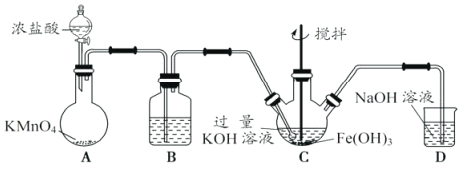
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
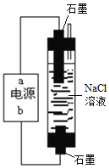
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
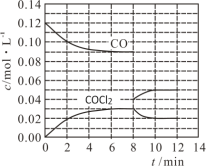
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
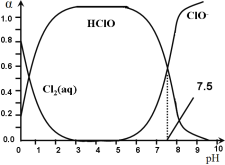
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】获取安全的饮用水成为人们关注的重要问题。回答下列问题:

(1)漂白粉常用于自来水消毒。工业上用氯气和石灰乳制取漂白粉的化学方程式为_________。实验室用MnO2与浓盐酸反应制备Cl2 的反应装置如图所示,制备实验开始时先检查装置气密性,接下来的操作依次是_____________________(填下列序号)。
①往烧瓶中加入浓盐酸 ②加热 ③往烧瓶中加入MnO2粉末
(2)聚铁[Fe2(OH)n(SO4)3-0.5n]m是一种高效无机水处理剂,制备原理是调节Fe2(SO4)3溶液的pH,促进其水解制取。用铁的氧化物制取聚铁的流程如下:
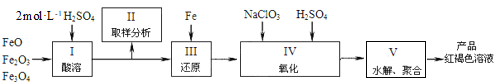
①实验室配制2mol·L-1的稀硫酸250mL需98%的浓硫酸(ρ=1.84g·mL-1)_______mL,配制过程中应使用的玻璃仪器有玻璃棒、烧杯、量筒、________________________。
②步骤Ⅳ中发生反应的离子方程式为_______________。
③步骤Ⅴ中需将溶液加热到70~80 ℃的目的是________________。Ⅴ中溶液的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的方法为_____________;若溶液的pH偏小,将导致聚铁中铁的质量分数__________(填“偏高”、“偏低”或“无影响”)。
(3)硬水易导致产生锅炉水垢[主要成分为CaCO3、Mg(OH)2、CaSO4],不仅会降低燃料的利用率,还会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。清除时首先用饱和Na2CO3溶液浸泡水垢,发生CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com