
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
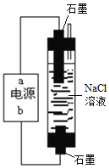
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
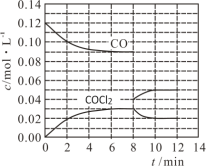
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
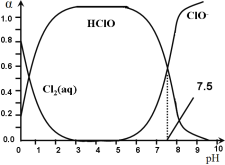
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
【答案】正 Cl- + H2O![]() ClO-+H2↑或2Cl- + 2H2O
ClO-+H2↑或2Cl- + 2H2O![]() 2OH-+H2↑+Cl2↑、Cl2+2OH- = ClO- + Cl- + H2O 0.005 mol ·L-1·min-1 减小CO的浓度(或分离出一定量CO) 减小 10-7.5 10-4.6 好
2OH-+H2↑+Cl2↑、Cl2+2OH- = ClO- + Cl- + H2O 0.005 mol ·L-1·min-1 减小CO的浓度(或分离出一定量CO) 减小 10-7.5 10-4.6 好
【解析】
(1)在电解池的阴极上是阳离子得电子发生得电子的还原反应,在阳极上是阴离子发生失电子的氧化反应,制备消毒液,氯气可以和强碱反应生成氯化钠、次氯酸钠和水,b为正极,电解食盐水生成NaOH、氢气、氯气,氯气与NaOH反应生成NaClO;
(2)根据图像可分析出CO和COCl2的浓度在不同时刻的变化状况,三行式运算即可,根据图象观察第8 min时CO、COCl2浓度变化,判断改变条件,根据勒夏特略原理分析平衡移动方向得出结论;
(3)①分析图象知,选特殊的点,pH=7.5,此时c(HClO)=c(ClO-),计算Ka值 ;
②利用盖斯定律找出K与K1、K2、Ka的关系,以此计算;
③HClO的杀菌能力比ClO-强,所以HClO的浓度越大,其杀菌效果越好。
(1)制备消毒液,应产生氯气,让它和强氧化钠反应生成氯化钠、次氯酸钠和水,所以,氯气应该在下端生成,下端为阳极生成氯气,b为正极,a为负极,电解食盐水生成NaOH、氢气、氯气,氯气与NaOH反应生成NaClO,则电解饱和食盐水制备84消毒液(NaClO溶液)的离子方程式为 Cl- + H2O![]() ClO-+H2↑或2Cl- + 2H2O
ClO-+H2↑或2Cl- + 2H2O![]() 2OH-+H2↑+Cl2↑ Cl2+2OH- = ClO- + Cl- + H2O;
2OH-+H2↑+Cl2↑ Cl2+2OH- = ClO- + Cl- + H2O;
(2) 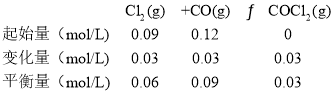
在0~6 min内v(Cl2)=△c /△t =(0.03mol/L)/ (6min) =0.005mol/(Lmin),
由图象可知第8 min时CO的浓度增大,但比原平衡小,且COCl2浓度减小,平衡逆向移动,所以改变的条件为减小CO的浓度(或分离出一定量CO),正反应为放热反应,升高温度平衡逆向移动,则COCl2的体积分数将减小;
(3)①由图象知,HClOH++ClO-中pH=7.5,此时c(HClO)=c(ClO-),![]() ;
;
Ⅰ.![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Ⅱ.Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
根据盖斯定律可得到:Ⅰ×2+Ⅱ可得Cl2(g)+H2OHClO+H++Cl- K,所以K=K12×K2=(10-0.6)2×10-3.4=10-4.6;
③起杀菌作用的是HClO,由图象可知,pH=6.5时c(HClO)比H=7.5时要大,HClO浓度越大,杀菌效果好,所以pH=6.5时杀菌效果比pH=7.5时好。


科目:高中化学 来源: 题型:
【题目】海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其工艺流程如图所示:
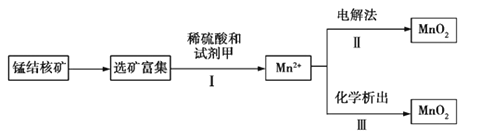
已知:化学析出时用NaClO3作析出试剂,每生成0.05 mol MnO2时消耗0.02 mol NaClO3。
根据以上工艺流程及信息,判断下列说法不正确的是
A.步骤Ⅰ中的试剂甲必须具有较强的还原性
B.步骤Ⅲ发生反应的离子方程式为2ClO3—+5Mn2++4H2O=5MnO2+Cl2+8H+
C.若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+
D.测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol·L-1 HCl标准溶液滴定的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为0.1 mol/L的HCl溶液V mL,加水稀释到2V mL,再取出10 mL,这10 mL溶液中c(H+)为
A.0.1 mol/LB.0.01 mol/LC.0.02 mol/LD.0.05 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现实验室需要450 mL 0.5 mol/L的NaOH溶液和500 mL 0.2 mol/L的H2SO4溶液。
请回答下列问题:
Ⅰ.配制NaOH溶液
【1】根据计算,用托盘天平称取NaOH固体的质量应为_____g。
A.0.9B.9.0C.10D.10.0
Ⅱ.配制稀H2SO4
某同学欲用质量分数为98%的浓硫酸(密度ρ=1.84 g/cm3)配制所需的稀H2SO4。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒;⑤500 mL容量瓶;⑥圆底烧瓶
【2】以上仪器中不需要的是
A.①B.②C.③D.⑥
【3】用量筒量取所需浓硫酸的体积应为_______mL。
A.5.4B.5.5C.18.4D.27.2
【4】如果实验室有10 mL、20 mL、50 mL的量筒,应选用_______mL量筒量取。
A.10B.20C.50D.以上都可以
【5】下列操作会使所配制的溶液浓度偏高的是
A.容量瓶中原来有少量蒸馏水未作处理
B.定容时仰视容量瓶刻度线
C.用量筒量取浓硫酸时仰视读数
D.定容时,不慎加水超过刻度线,又用滴管将多出部分吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲酸的酸性强于醋酸。
(1)醋酸铵溶液呈中性,则甲酸铵溶液的pH____7(填“>”、“<”或“=”);若HCOONH4、NH4HSO4、NH4Cl三种溶液中的c(NH4+)相同,则c(HCOONH4)、c(NH4Cl)、c(NH4HSO4)的由大到小的顺序是_____________________________________。
(2)常温下0.01 mol·L-1 的氨水中![]() ,该溶液的pH为_________。向0.01 mol·L-1的甲酸溶液中逐滴加入0.01 mol·L-1的氨水,该过程中的离子浓度关系不可能为__________。
,该溶液的pH为_________。向0.01 mol·L-1的甲酸溶液中逐滴加入0.01 mol·L-1的氨水,该过程中的离子浓度关系不可能为__________。
A.c(HCOO-)>c(H+)>c(NH4+)>c(OH-) B.c(HCOO-)> c(NH4+)> c(H+) >c(OH-)
C.c(HCOO-)= c(NH4+) > c(H+) =c(OH-) D.c(HCOO-)> c(NH4+)>c(OH-)> c(H+)
E.c(NH4+)>c(HCOO-)> c(OH-)>c(H+)
(3)如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂a附近的pH_______(填“增大”、“不变”或“减小”),催化剂b表面发生的电极反应式为___________________。
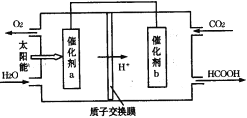
(4)常温下,0.02 mol·L-1的HCOONa溶液pH=8,则常温下HCOOH的电离常数Ka约为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com