
【题目】海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其工艺流程如图所示:
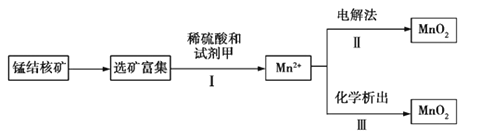
已知:化学析出时用NaClO3作析出试剂,每生成0.05 mol MnO2时消耗0.02 mol NaClO3。
根据以上工艺流程及信息,判断下列说法不正确的是
A.步骤Ⅰ中的试剂甲必须具有较强的还原性
B.步骤Ⅲ发生反应的离子方程式为2ClO3—+5Mn2++4H2O=5MnO2+Cl2+8H+
C.若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+
D.测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol·L-1 HCl标准溶液滴定的方法
【答案】D
【解析】
A. 步骤I中,Mn元素的化合价由+4价降低为+2价,则试剂甲应具有还原性,A正确;
根据已知条件,步骤Ⅲ中,用NaClO3作析出试剂,是利用NaClO3的氧化性,生成0.05 mol B. MnO2消耗0.02 mol NaClO3,由得失电子守恒知,NaClO3的还原产物为Cl2,离子方程式为2ClO3—+5Mn2++4H2O=5MnO2+Cl2+8H+,B正确;
C. 根据图示,Mn元素的化合价由+2价降低为+4价,发生氧化反应,用电解法,阳极发生氧化反应,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,C正确;
D. 不能用盐酸来滴定Mn,D错误。


科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓) ![]() CuSO4+X↑+2H2O试通过计算和推理回答下面的问题:
CuSO4+X↑+2H2O试通过计算和推理回答下面的问题:
(1)X物质可以导致酸雨的形成,X应该属于________(填字母代号)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)X物质可以使酸性KMnO4溶液褪色,该过程中(填化学式,下同)______失去电子,氧化剂是______。
(3)足量的铜片与20mL18mol·L-1的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为______mol,生成的X气体在标准状况下体积为______L(假设气体全部逸出)。
(4)将(3)反应后得到的溶液与过量Ba(OH)2溶液混合,充分反应,反应后所得沉淀的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用滤纸折成一个纸蝴蝶,并喷洒一种溶液(保持湿润),挂在铁架台上,将盛某种溶液的烧杯放在纸蝴蝶的下方,如图所示。向烧杯中加入另一种物质,过一会儿发现纸蝴蝶变为红色且保持红色不变,下面的组合能够实现上述变化的是( )
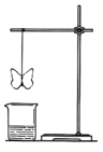
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
烧杯中的溶液 | 浓硫酸 | 氯化铵 | 稀硫酸 | 高锰酸钾 |
加入烧杯中的物质 | 铜 | 氢氧化钠浓溶液 | 氨水 | 浓盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和02。下列说法中正确的是

A. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
B. 该电池放电时,Li+向电极X方向移动
C. 该电池充电时,电极Y与外接直流电源的负极相连
D. 该电池放电时,每转移4mol电子,理论上生成1molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图形相符的是( )
A.  NaHSO3 粉末加入HNO3溶液中B.
NaHSO3 粉末加入HNO3溶液中B. 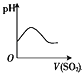 SO2气体通入新制氯水中
SO2气体通入新制氯水中
C. 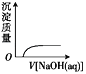 NaOH溶液滴入 Ba(HCO3)2溶液中D.
NaOH溶液滴入 Ba(HCO3)2溶液中D.  CO2气体通入澄清石灰水中
CO2气体通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是火箭的固体燃料,发生反应为
是火箭的固体燃料,发生反应为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 溶于水电离方程式为
溶于水电离方程式为![]()
B.反应中还原产物分子数与氧化产物分子总数之比为1∶3
C.产生![]() 反应转移的电子总数为
反应转移的电子总数为![]()
D.![]() 分解产生的气体体积为44.8L
分解产生的气体体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为18.4 mol/L的浓硫酸来配制 500 mL0.46 mol/L的稀硫酸,可供选择的仪器有:①玻璃棒②烧杯③胶头滴管④量筒⑤容量瓶⑥托盘天平⑦药匙
(1)上述仪器中,配制过程中用不到的有________。
(2)计算所需浓硫酸的体积为_________mL。
(3)在配制过程中,下列操作可引起所配溶液浓度偏高的有_________。(填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
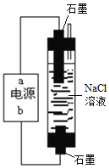
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
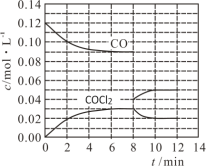
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
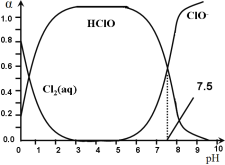
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com